ATMP - génová a bunková terapia a lieky tkanivového pôvodu
Nové terapie prinášajú zásadné zmeny v liečbe závažných ochorení
Desaťročia výskumu procesov na bunkovej a genetickej úrovni priniesli pokrok vo vývoji inovatívnych terapií. Tie zásadne menia prístupy k liečbe mnohých, doteraz neliečiteľných a aj zriedkavých ochorení. Ich podaním dochádza k výraznému zvyšovaniu miery prežívania pacientov, zlepšovaniu kvality ich života a v mnohých prípadoch aj úplnému uzdraveniu.
Na príchod modernej liečby patriacej do skupiny tzv. liekov na inovatívnu terapiu (Advanced Therapies Medicinal Products - ATMP) reaguje aj európska legislatíva. ATMP je definovaná Nariadením Európskeho parlamentu a Rady (ES) č. 1394/2007 z 13. novembra 2007 o liekoch na inovatívnu liečbu, ktorým sa mení a dopĺňa smernica 2001/83/ES a nariadenie(ES) č. 726/2004. Ako sa v nariadení uvádza[1], ATMP možno rozdeliť do troch hlavných typov: génová terapia, bunková terapia a lieky tkanivového pôvodu.
Hlavné typy ATMP podľa EMA
Génová terapia: obsahuje gény, ktoré vedú k terapeutickému, profylaktickému alebo diagnostickému účinku. Fungujú tak, že sa do tela vložia "rekombinantné" gény, zvyčajne na liečbu rôznych ochorení vrátane genetických porúch, rakoviny alebo dlhodobých ochorení. Rekombinantný gén je úsek DNA, ktorý sa vytvára v laboratóriu spojením DNA z rôznych zdrojov;
Bunková terapia: obsahuje pacientove vlastné bunky alebo tkanivá, ktoré boli upravené s cieľom zmeniť ich biologické vlastnosti, alebo bunky či tkanivá, ktoré nie sú určené na používanie na tie isté základné funkcie v tele. Môžu sa použiť na liečenie, diagnostiku alebo prevenciu chorôb;
Lieky tkanivového pôvodu: obsahujú bunky alebo tkanivá, ktoré boli upravené tak, aby sa mohli použiť na opravu, regeneráciu alebo náhradu ľudského tkaniva;
Zdroj: EMA
Nové možnosti liečby rakoviny, zriedkavých aj neurologických ochorení
Podľa údajov z AIFP Horizon scanningu 2021-2022[2] je v súčasnosti registrovaných, v procese registrácie alebo v klinickom skúšaní celkovo 33 indikácií génovej terapie alebo bunkovej CAR-T terapie. Registrovaných je z nich dnes celkovo 13 ATMP indikácií, pričom najviac - sedem je v onkológií. Ďalšie tri sú v oblasti kardiovaskulárnych a metabolických ochorení, dve v neurológii a jedna v imunológii.
Indikácie – registrácie a oblasti liečby
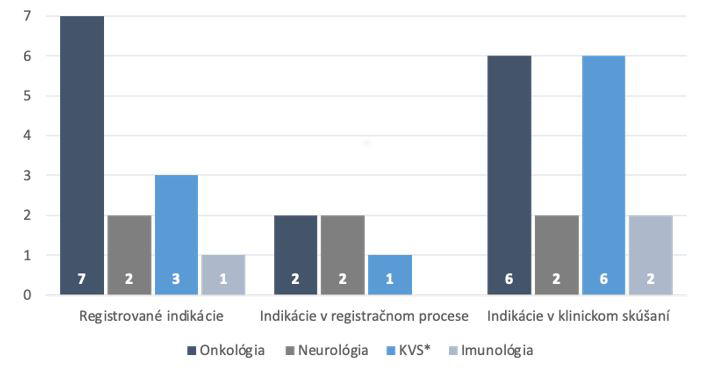
Zdroj: Horizon scanning 2021-2022, AIFP
*v prípade registrovaných indikácii = KVS (kardiovaskulárne)+metabolické ochorenia
Spomedzi registrovaných indikácií je 7 génových terapií a šesť CAR-T. V klinickom skúšaní je ďalších 15 indikácií, z toho po šesť v onkológií a kardiovaskulárnej medicíne. Dve indikácie sú v neurológii a imunológii. Až v jedenástich prípadoch sa jedná o génovú terapiu.
Indikácie – registrácie a typ terapie
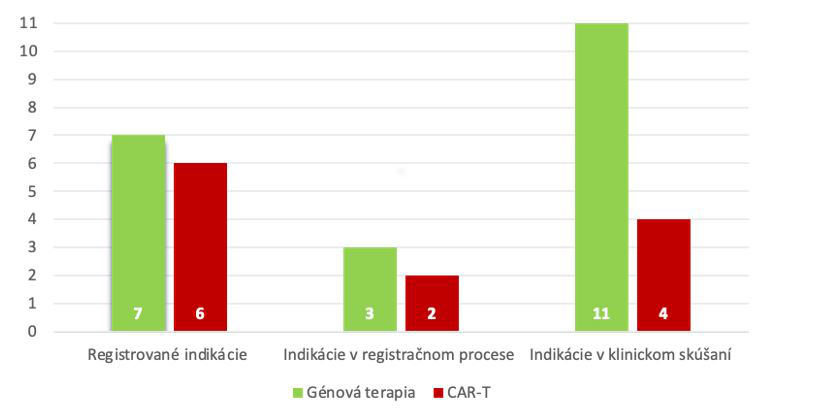
Zdroj: Horizon scanning 2021-2022, AIFP
ATMP sa výrazne líšia od „klasických“ liekov
Produkcia modernej liečby spadajúcej do kategórie ATMP sa výrazne líši od výroby a distribúcie „klasických“ liekov. ATMP dnes predstavujú logistickú výzvu. Ich produkcia je zložitá a spojená s náročnými schvaľovacími procesmi, keďže liečba je vysoko individualizovaná. ATMP však majú potenciál eliminovať alebo opraviť bunky, ktoré priamo zapríčiňujú dané ochorenie. To predstavuje liečebný postup s možnosťami riešenia tzv. neuspokojených medicínskych potrieb (unmet medical need). Dnes je totiž väčšina schválených ATMP zameraná práve na indikácie zriedkavých ochorení (tzv. orphan disease)[3] a onkologických ochorení2. Príkladom je CAR-T terapia na liečbu rakoviny krvi. Podľa slov doc. MUDr. Ľuboša Drgoňu, CSc., MHA, FECMM, prednostu Kliniky onkohematológie LFUK a NOÚ, je poskytovanie takéhoto druhu terapie komplikovaný proces, ktorý si vyžaduje viacero následných krokov. Tie je potrebné nastaviť tak, aby sa dosiahol čo najlepší výsledok liečby, a to od odobrania vlastných buniek pacienta, po ich spracovanie v certifikovanom laboratóriu a následné podanie pacientovi. Po podaní terapie je dôležité pacienta odsledovať a dokázať manažovať aj prípadné nežiadúce účinky alebo následky jej podania.
Prelomovou oblasťou je však aj neurológia. Ako uviedla prednostka Kliniky detskej neurológie NÚDCH doc. MUDr. Miriam Kolníková, PhD, v detskej neurológii nastal v ostatných piatich rokoch veľmi výrazný pokrok v liečbe, obzvlášť v nervovo-svalových ochoreniach detí. V najbližších rokoch očakáva príchod inovatívnej liečby aj v iných oblastiach neurologických ochorení.
Pokrok v terapii si vyžaduje zmenu: finančnú, aj praktickú
Úspechy v liečbe, ktoré prinášajú ATMP, na druhej strane predstavujú výzvu pre systémy financovania zdravotníctva. Štandardné schémy financovania sa v tomto prípade dajú uplatňovať len v obmedzenej miere a potrebné je širšie využívanie alternatívnych spôsobov stanovenia úhrad. Krajiny, kde sa ATMP v praxi už dnes používajú, si stanovujú viaceré podmienky, za ktorých sú dnes ochotné liečbu hradiť. Aj keď sa kritériá v detailoch líšia, najčastejšie ich spája hodnotenie medicínskej potreby, klinický prínos – účinnosť terapie (ukazovatele ako celkové prežívanie, prežívanie bez progresie, potreba následnej liečby), jej bezpečnosť, či inovatívnosť. Vo väčšine krajín dnes nie je nákladová́ efektívnosť liečby výlučné kritérium pre úhradu ATMP. Ak je aj požadované jej splnenie, úroveň prahovej hodnoty je výrazne vyššia ako pri iných inovatívnych liekoch. Tento fakt je potrebné zdôrazniť hlavne pri pohľade na nastavenie súčasného slovenského systému stanovovania úhrad, ktorý predstavuje v tomto ohľade výraznú bariéru dostupnosti inovatívnej liečby pre pacienta.
Napomôcť by v tomto smere mala novela zákona č. 363/2011 o rozsahu a podmienkach úhrady liekov, zdravotníckych pomôcok a dietetických potravín na základe verejného zdravotného poistenia, ktorá rozširuje možnosti vstupu inovatívnej terapie do úhradového systému, pričom definíciu takejto liečby explicitne prebrala z Nariadenia Európskeho parlamentu a Rady (ES) č. 1394/2007 z 13. novembra 2007 o liekoch na inovatívnu liečbu. Ako v tejto súvislosti uviedol doc. MUDr. Ľuboš Drgoňa, v novele zákona č. 363/2011 sú ustanovenia, ktoré by mohli viesť k zlepšeniu dostupnosti inovatívnych liekov pomocou rôznych úhradových schém, bežných v okolitých krajinách. Tie umožňujú väčší manévrovací priestor pre platcov a aj výrobcov inovatívnych liekov na to, aby mohli dostať konkrétny produkt k pacientovi.
Pri zlepšení zákonných podmienok však cesta ATMP k pacientom iba začína. Pre podávanie a následné sledovanie účinnosti a bezpečnosti terapie je potrebné vytvorenie vysokošpecializovaných certifikovaných klinických pracovísk a edukácia zdravotníckych expertov, ktorí sa na liečbe podieľajú. Takéto certifikované centrá a laboratóriá vznikli už pred niekoľkými rokmi v Českej republike a so slovenskými špecializovanými centrami spolupracujú. Prvé kroky k vlastnej certifikácií už podnikol aj Národný onkologický ústav.
Horizon scanning ukazuje, že nové ATMP budú prichádzať rýchlo. Cestou ako ich dostať včas k slovenským pacientom je úzka spolupráca medzi odborníkmi, zdravotnými poisťovňami, ministerstvom zdravotníctva aj výrobcami liekov. Ak cestu našli okolité krajiny, vrátane našich najbližších susedov, určite sa to podarí aj odborníkom na Slovensku.
[1] EMA, Advanced therapy medicinal products: Overview (link)
[2] Horizon scanningu 2021-2022, analýza AIFP
[3] Pizevska, M., Kaeda, J., Fritsche, E., Elazaly, H., Reinke, P. and Amini, L., 2022. Advanced Therapy Medicinal Products Translation in Europe: A Developers Perspective. (link)
