Vakcíny
Očkovanie dnes chráni milióny ľudí pred prenosnými ochoreniami. Definícia vakcín sa s novými objavmi začína meniť. V budúcnosti by mohli vycvičiť náš imunitný systém proti rakovine i cigaretám.
Úsvit vakcín
V osemnástom storočí sa južným Anglickom každých pár rokov prehnala vlna epidémie kiahní. Asi každý tretí nakazený človek chorobe podľahol, tretina ľudí stratila zrak a takmer všetci ostali trvalo poznačení jazvami. Miestni farmári a dojičky poznali spôsob, ako sa pred chorobou ochrániť. Vedeli, že ak sa pri dojení nakazia od kráv a na rukách sa im ukážu podobné pľuzgiere, aké majú zvieratá v okolí vemien, tak budú mať pri ďalšej epidémií šancu vyhnúť sa chorobe.
To zaujalo miestneho lekára Edwarda Jennera (a na iných miestach nezávisle aj ďalších), ktorý sa v roku 1796 rozhodol, že vyskúša zaočkovať osemročného chlapca hnisom z pľuzgieru na rukách dojičky. O niekoľko týždňov Jenner svoj experiment otestoval – chlapcovi vpichol na dve miesta na ruke kiahne. Na chlapcovi sa ochorenie neprejavilo, podobne reagovali ďalší ľudia.
V tom čase ešte nikto presne nevedel, čo sú to kiahne a že vôbec existujú nejaké vírusy či baktérie. Vakcína proti kiahňam bola výsledkom pozorovaní a experimentovania. Jennerove experimenty mali ešte ďaleko k moderným postupom či hygienickým štandardom. Pri odberoch a následných očkovaniach sa mohli prenášať rôzne ochorenia. Nebolo to ale v tom čase nič neobvyklé, keďže vedecké a medicínske poznanie o mikroorganizmoch a dôležitosti hygieny sa začali výrazne rozvíjať až desaťročia po prvých Jennerovych experimentoch.
S rozšírením očkovania proti kiahňam v Európe a USA sa začali rozvíjať aj imunológia a vakcinológia. Na ďalší veľký prelom si tieto mladé vedné odbory počkali vyše sto rokov. V roku 1885 prišiel Louis Pasteur s očkovaním proti besnote. Besnota bola v tom čase jedna z najsmrteľnejších chorôb bez akejkoľvek liečby, úmrtnosť po nakazení bola takmer stopercentná. Vakcína bola vyrobená z vysušeného nervového tkaniva nakazených zajacov a najskôr ju Pasteur testoval na psoch. Prvým zaočkovaným človekom bol deväťročný chlapec, ktorý dostal dávku až po tom, ako ho uhryzol besný pes. Infekcia besnoty má dlhú inkubačnú dobu, vakcína tak stihla úspešne zabrať pred prepuknutím choroby.
Pasteur, ako bolo v tom čase štandardom, stále pracoval so „živým“ materiálom. Základom jeho vakcíny boli oslabené vírusy besnoty pochádzajúce z vysušeného nervového tkaniva. Jeho používanie mohlo v zriedkavých prípadoch vyvolať prudké záchvaty či paralýzu (približne jeden prípad z 250, teda 0,4 percenta). Na oslabovanie vírusu, ktoré bolo veľkým posunom, prišli v Pasteurovom laboratóriu v podstate náhodou. Jeden zo spolupracovníkov nechal omylom dlhší čas na vzduchu kultúry vtáčej cholery a tie boli následne také slabé, že nevyvolali u zaočkovaných kurčiat ochorenie, ale vybudovali im imunitu.
Prvá fáza vývoja vakcín sa končí pri Johnovi Kolmerovi a Maurice Brodim, ktorí pred druhou svetovou vojnou hľadali vakcínu proti detskej obrne. Aj keď každý pracoval samostatne, ich spoločným základom bolo nervové tkanivo nakazených opíc, z ktorého izolovali vírus obrny. Výsledky sa ukázali byť katastrofálne – u viacerých detí sa prejavila choroba, ktorej podľahli, a veľa z nich ostalo paralyzovaných. Obaja síce k vírusu pridávali ešte rôzne chemikálie, tie ale nedokázali dostatočne potlačiť silu vírusov. Na účinnú a bezpečnú vakcínu proti detskej obrne si ľudstvo muselo ešte pár rokov počkať.
Zároveň s vývojom oslabených vírusov sa však začal výskum inaktivovaných patogénov, ktoré sú aj dnes súčasťou niektorých moderných vakcín. Ide o vakcíny obsahujúce neživé mikroorganizmy, ktoré sú vypestované v kultúre a neskôr inaktivované s pomocou tepla alebo iných látok. Inaktivované patogény sa najskôr využívali vo veterinárnej praxi, neskôr sa začali vyvíjať pre ochorenia ako týfus, cholera alebo mor. S inaktivovanými patogénmi bolo vtedy ešte spájaných niekoľko rizík – aby dokázali vakcíny zapôsobiť, bolo potrebné aplikovať viaceré dávky; po určitom čase teda museli byť podané dávky na opätovné posilnenie imunity (preočkovanie). Moderné vakcíny dokázali tieto problémy odstrániť.
Zlatý vek vakcín (1950 – 2000)
V roku 1928 ukázali experimenty manželov Hugha a Mary Maitlandovcov, že je možné vypestovať vírus aj mimo živých zvierat, iba s použitím ich tkaniva. Maitlandovci vypestovali vírus kravských kiahní (podobný tomu, s ktorým pracoval Jenner) v zmesi tkaniva zo slepačej obličky, organickej soli a živinového roztoku. Tento objav viedol k ďalším pokusom, keďže práca s tkanivom bola jednoduchšia, rýchlejšia a prinášala lepšie výsledky.
Podobným smerom išiel o tri roky neskôr aj americký patológ a lekár Ernest Goodpasture. Ten zistil, že viacero ľudských vírusov je možné vypestovať s pomocou slepačích vajec. Dovtedy sa na pestovanie ľudských vírusov používali napríklad myši alebo fretky. Vajcia boli lacné, no predovšetkým predstavujú prirodzený stabilný inkubátor s vhodnými podmienkami pre rast vyše tridsiatich druhov vírusov.
Vakcínami proti každodenným zabijakom
Vývoj vakcín nabral na obrátkach po roku 1949, kedy trojica výskumníkov John Enders, Thomas Weller a Frederick Robbins úspešne nadviazala na prácu svojich predchodcov a zistila, ako vypestovať vírus detskej obrny v rôznych bunkových kultúrach (in vitro). Dovtedy sa tento aj mnohé ďalšie vírusy pestovali iba v nervovom tkanive usmrtených laboratórnych zvierat. Enders, Weller a Robbins dostali za svoj objav v roku 1954 Nobelovu cenu za medicínu. Ďalší vedci vďaka nim získali nástroj na štúdium vírusov a možnosť vyrábať bezpečnejšie vakcíny rýchlejšie. Ich objav tak umožnil masovú výrobu očkovacích látok.
A práve vďaka tomuto objavu sa už o štyri roky neskôr dostavili prvé hmatateľné výsledky v podobe dvoch vakcín proti detskej obrne – išlo o Salkovu vakcínu a Sabinovu vakcínu. Pred objavením vakcíny proti obrne zomrelo alebo ostalo paralyzovanými na celom svete asi milión ľudí každý rok a približne do roku 1900 pravidelne prepukali na celom svete epidémie tohto ochorenia.
Jonas Salk pracoval na vývoji formaldehydom inaktivovanej polio-vakcíne (IPV), ktorá bola pripravená na klinické skúšky v roku 1954. Išlo pravdepodobne o najväčšie klinické skúšanie v dejinách, zapojilo sa doň 1,8 milióna detí, z ktorých 420-tisíc dostalo vakcínu a 200-tisíc dostalo placebo. Zvyšných 1,2 milióna detí tvorilo kontrolnú skupinu. Testovaná vakcína sa ukázala byť vysoko účinná a bezpečná.
Pri jej následnej produkcii sa ale v jednom z laboratórií vyskytla výrobná chyba, pre ktorú ostala vo vakcínach časť živého vírusu. To malo za následok niekoľko prípadov úmrtia na obrnu a desiatky detí ostalo trvalo paralyzovaných. Zároveň to však prispelo k zvýšeniu bezpečnostných štandardov a sprísňovaniu pravidiel určujúcich kto a za akých podmienok môže vakcíny vyrábať. Pri dnešných postupoch je prakticky vylúčené, aby sa takáto chyba opakovala. Napriek tomu bola Salkova vakcína v tom čase obrovským úspechom: v USA bolo v roku 1955 takmer 29-tisíc prípadov detskej obrny, o dva roky už menej ako 6-tisíc prípadov. V roku 1959 používalo Salkovu vakcínu ďalších 90 krajín. Viaceré farmaceutické spoločnosti dostali zadarmo prístup ku zloženiu vakcíny a postupu jej výroby.
Dnes sú bežne do testovania zapojené tisíce jedincov. To je vďaka moderným postupom v metodológii vied a štatistike vyhovujúci počet, ktorý dokáže overiť bezpečnosť vakcíny.
Zároveň s vývojom IPV pracoval Albert Sabin na vakcíne, ktorá sa podávala ústne (na rozdiel od Salkovej, ktorá sa aplikovala pod kožu) a obsahovala živý oslabený vírus obrny. Bola to práve Sabinova vakcína, ktorá sa až do konca deväťdesiatych rokov úspešne používala vo väčšine krajín sveta, a ktorá prispela k odstráneniu obrny zo západnej pologule.
Na podobnom princípe ako vakcína proti detskej obrne boli založené aj vakcíny proti osýpkam (1963), mumpsu (1967) a ružienke (1969). Vo všetkých prípadoch išlo o ochorenia, ktoré boli v tom čase bežné a úmrtnosť na ne vysoká.
V posledných desaťročiach dvadsiateho storočia už technológia vo vakcinácii pokročila od pestovania a produkcie patogénov vo veľkom k definovaniu a výberu iba niektorých ich častí, napríklad jednotlivých bielkovín. Ide o pokračovanie prístupu, ktorý prišiel s poznaním, že v niektorých vakcínach je zbytočné nechávať celý mikroorganizumus.
Odstránenie niektorých častí patogénov zvýšilo bezpečnosť vakcín a znížilo pravdepodobnosť nežiaducej reakcie.
Väčší komfort pri aplikácii vakcín zabezpečujú aj kombinované vakcíny, ktoré v sebe spájajú antigény viacerých ochorení. Kombinované vakcíny sa používajú už viac ako päťdesiat rokov, medzi ich hlavné prednosti patria potreba iba jedného vpichu, nižšie náklady v porovnaní so sumou za každú jednotlivú vakcínu, šetrenie času (stačí jedna návšteva u lekára) a zabezpečenie včasnosti očkovania.
Najstaršou kombinovanou vakcínou je DTP vakcína proti záškrtu, tetanu a čiernemu kašľu , ktorá v USA získala licenciu už v roku 1949.
Vakcíny v prechode
Do prelomu tisícročí sa už podarilo nájsť vakcíny a dostať pod kontrolu väčšinu najzávažnejších prenosných ochorení. V tomto období sa preto postupne začína pracovať na vývoji vakcín, ktoré pôsobia preventívne aj terapeuticky.
To je možné vďaka vedeckému a technologickému pokroku, ktorý sa začal v osemdesiatych rokoch s rozvojom genetiky. Umožnil posunúť sa od výroby vakcín s priamym použitím biologického materiálu ku geneticky „skonštruovaným“ vakcínam. Prvou takouto vakcínou bola vakcína proti vírusu hepatitídy B (ochorenie môže spôsobiť rakovinu pečene), v polovici roku 2006 nasledovala vakcína na prevenciu proti infekcii ľudským papiloma vírusom (HPV), ktorý spôsobuje rakovinu krčka maternice, vulvy či penisu.
Rozširovanie pochopenia molekulárnych a genetických mechanizmov viedlo v deväťdesiatych rokoch aj k vývoju technológií preskupovania (reassortment) a rekombinácie, s pomocou ktorých dokážeme medzi vírusmi meniť časti ich genetickej informácie.
Výrobným základom preskupovania je infekcia bunky v rovnakom okamihu dvomi vírusmi, ktoré si vymenia časť genetickej informácie, a vznikne tak vírus, ktorý je kombináciou oboch pôvodných vírusov. Ide o proces, ktorý sa bežne deje aj v prírode – podobným spôsobom sa menia aj samotné infekčné ochorenia (napr. zmeny vírusu sezónnej chrípky). Laboratórnym preskupovaním je možné dosiahnuť vznik takej štruktúry vírusu, ktorá obsahuje všetky požadované súčasti, na ktoré chceme zacieliť imunitný systém. 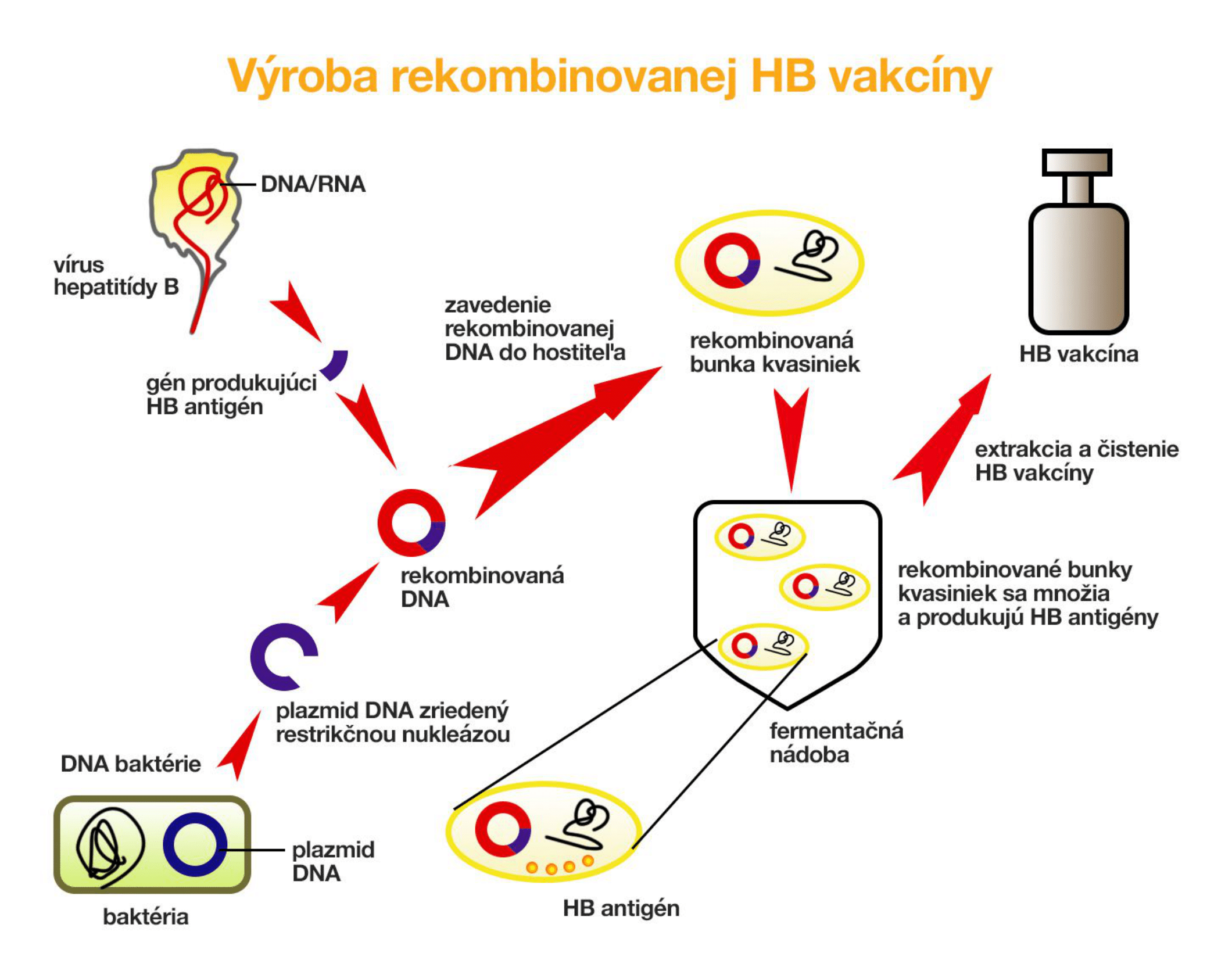 Výhodou tak je, že vakcína obsahuje menej antigénov a účinne chráni proti viacerým typom ochorenia.
Výhodou tak je, že vakcína obsahuje menej antigénov a účinne chráni proti viacerým typom ochorenia.
Preskupovanie prispelo napr. k vytvoreniu vakcíny proti rotavírusu, ktorý u malých detí vyvoláva závažný zápal tráviaceho traktu spojený s horúčkou, dehydratáciou a ďalšími komplikáciami vyžadujúcimi si každoročne tisíce hospitalizácií. V rozvojových krajinách je rotavírus stále jeden z najväčších zabijakov detí.
Vakcína proti infekcii HPV bola vyrobená s pomocou rekombinácie. Ide o proces „rozobratia“ genómu HPV vírusu, pri ktorom sa gén kódujúci povrchový proteín HPV (L1 proteín) naklonuje do hostiteľa (napríklad kvasinky alebo bakulovírusu motýľov). Pri následnom množení hostiteľa vznikajú vysoko čistené častice podobné vírusu, z ktorých sa v ďalších krokoch vyrába vakcína. Výhodou rekombinácie je, že ide o čistú výrobu. Nepracuje sa pri nej so živým antigénom (vírusom), používa sa iba časť jeho genetického materiálu. Nehrozí teda riziko nakazenia samotným ochorením.
Vakcínami proti baktériám
Existuje niekoľko spôsobov, ako dokážu vakcíny pôsobiť aj proti ochoreniam spôsobeným baktériami. Môžu pracovať s inaktivovanými toxínmi, polysacharidmi alebo konjugovanými polysacharidmi.
Na čierny kašeľ, ktorý je spôsobený baktériou Bordetella pertussis, každoročne zomrie niekoľko desiatok tisíc ľudí na celom svete. Stále je to však iba asi desatina z počtu úmrtí pred zavedením očkovania v päťdesiatych a šesťdesiatych rokoch dvadsiateho storočia. Baktéria pertussis bola izolovaná v roku 1906 a od roku 1948 sa proti ochoreniu očkovalo spoločne v prvej kombinovanej vakcíne DTP (záškrt, tetanus, čierny kašeľ). Používaná bola „celobunková“ (whole-cell) vakcína, ktorá obsahovala suspenziu celého organizmu inaktivovanej baktérie.
Takýto typ vakcíny bol pomerne efektívny a nenákladný, bol však spojený so zvýšeným výskytom nežiaducich účinkov. O niekoľko desaťročí sa začalo pracovať na vývoji acelulárnych kombinovaných vakcín. Tie už obsahujú čistené časti (toxíny) inaktivovaných baktérií, vakcíny tak vyvolávajú menšie nežiaduce účinky a môžu byť podávané aj deťom, ktoré nemohli byť očkované celobunkovou vakcínou.
Lepšia ochrana detí
Čisté polysacharidové vakcíny boli vyvinuté tak, aby trénovali imunitný systém k vybudovaniu reakcie na polysacharidy baktérií. Polysacharidy umožňujú baktériám „oklamať“ imunitný systém: obalia proteín, ktorý pomáha telu nájsť a zničiť antigény – imunitný systém tak nevie baktériu rozpoznať.
Tento typ vakcín dlho chránil pred viacerými chorobami spôsobenými meningokokmi, pneumokokmi alebo baktériam Haemophilus influenzae typu B (Hib). Po čase sa ale ukázali aj nedostatky: po opakovaných očkovaniach klesala ich účinnosť, slabý účinok na nositeľov baktérií či nemožnosť aplikovať ich deťom mladším ako dva roky, ktoré boli týmito ochoreniami najohrozenejšie.
S riešením týchto nedostatkov prišli konjugované vakcíny. Tie dokážu naviazať antigén alebo viacero antigénov na proteín, čo pomáha telu rozpoznať antigén ako cudziu látku a zničiť ju. Výhodami konjugovaných vakcín sú jednak dlhšia ochrana proti baktériám, ale aj posilňovanie odpovede imunitného systému pri opakovaných dávkach vakcíny pri použití menšieho počtu antigénov.
Zápal pľúc spôsobený pneumokokmi je najčastejšou príčinou úmrtia detí v rozvojových krajinách. Veľkou výhodou konjugovaných vakcín tak je, že môžu byť aplikované aj malým deťom do dvoch rokov veku. Mechanizmus fungovania konjugácie bol známy už od konca dvadsiatych rokov, konjugované vakcíny ale prišli až o takmer šesť desaťročí neskôr. Prvá konjugovaná vakcína pre ľudí dostala v USA licenciu v roku 1987 a chránila proti Hib. Zakrátko sa vďaka dobrým výsledkom dostala do štátneho imunizačného programu a pomohla znížiť výskyt ochorenia. Prispela tiež k tomu, že vývoju konjugovaných vakcín bola venovaná väčšia pozornosť.
Látky, ktoré pomáhajú vakcínam lepšie pôsobiť
Pokrok pri vývoji vakcín priniesol výzvu aj pre vývoj pomocných látok (adjuvantov). Moderné vakcíny totiž obsahujú často iba zlomky antigénov, prípadne sú syntetické. V porovnaní so „starými“ vakcínami, ktoré obsahovali celé živé alebo inaktivované organizmy, tie súčasné vyvolávajú omnoho slabšie reakcie, teda žiaducu odpoveď tela po aplikácii vakcíny . Súbežne s hľadaním tých správnych vakcín pre jednotlivé ochorenia tak už od prvých desaťročí dvadsiateho storočia prebieha aj výskum zameraný na hľadanie spôsobov, ako posilniť imunitnú odpoveď po aplikácii vakcíny – teda ako čo najbezpečnejšie posilniť a predĺžiť jej účinok.
Hoci bolo za ostatných deväťdesiat rokov skúšaných množstvo adjuvantov, iba niekoľko z nich sa osvedčilo v klinickom skúšaní. Súvisí to najmä s bezpečnosťou, ktorá sa s ďalším výskumom neustále zvyšuje.
Do polovice štyridsiatych rokov výskum ukázal dva hlavné systémy pomocných látok. Prvým bol systém využívajúci hlinité soli, ktorý vyvolával menej nežiaducich reakcií a bol stredne efektívny. Druhým, efektívnejším no s väčšou reaktogenitou, bol systém emulzií vody v oleji. Počas nasledujúcich rokov sa tieto dva systémy testovali a výskum sa snažil prekonávať rôzne praktické obmedzenia (čo fungovalo v prípadne jednej vakcíny, nemuselo platiť pri ďalšej).
Začiatok osemdesiatych rokov 20. storočia priniesol nové výzvy pre vývoj adjuvantov. Rekombinácia DNA a výroba vakcíny proti hepatitíde B ukazuje, že niektoré druhy geneticky upravených antigénov bude možné aktivovať iba s pomocou správnych adjuvantov – ináč by ich organizmus nerozoznal a nereagoval by podľa očakávaní.
Dnes sú stále vo väčšine krajín sveta povolené iba adjuvanty vychádzajúce zo zlúčenín hliníka, aj keď s výnimkami. Zlúčeniny hliníka sú nerozpustné vo vode a po aplikácii vakcíny sa rozpúšťajú v bunkových tekutinách. Ich hlavnou výhodou je, že sú neškodné, a dokážu postupne uvoľňovať malého množstvo antigénov po veľmi dlhý čas.
Ako sa vakcíny dostanú na trh
Výroba novej vakcíny v priemere trvá 8 až 18,5 roka a celkové náklady na jej uvedenie sa pohybujú od 200 do 900 miliónov dolárov . Bezpečnosť je pri vakcínach vzhľadom na ich používanie širokou populáciou prioritná. Proces výroby vakcíny zahŕňa viacero fáz:
- výrobca najskôr musí určiť antigén ktorý má potenciál v tele vyvolať ochrannú imuntinú odpoveď;
- prvá a druhá fáza klinického testovania zisťuje reakcie imunitného systému, pomáha určiť vhodné dávkovanie a vyhodnocuje bezpečnosť vakcíny;
- bezpečnosť, efektívnosť a konzistentnosť konečného produktu sa zisťuje v tretej fáze klinického testovania, v ktorej je zapojených niekoľko desiatok tisíc ľudí;
- výrobca predkladá výsledky testov, spolu s rôznymi ďalšími dokumentami popisujúcimi bezpečnosť a pôsobenie vakcíny, ku žiadosti o schválenie pre široké používanie. Po schválení sa stále sleduje a vyhodnocuje bezpečnosť vakcíny a výrobcovia spolupracujú s regulačnými orgánmi.
Vakcíny sú takmer vždy podávané zdravým jedincom. Aj z tohto dôvodu sú možné nežiaduce účinky a prejavy, v porovnaní s inými postupmi či liečivami, posudzované oveľa prísnejšie.
Prevencia, ktorá sa oplatí
Každých päť minút zachránia vakcíny niekomu život. (WHO)
Vakcíny dokážu veľmi efektívne zachraňovať životy. Úmrtnosť na prenosné ochorenia celosvetovo klesla z 33 percent zo všetkých ochorení v roku 1990 na 25 percent v roku 2010 a očkovanie k tomu významne dopomohlo. Len pravé kiahne v dvadsiatom storočí zabili 300 miliónov ľudí a vďaka vakcíne sa podarilo toto ochorenie úplne odstrániť (eradikovať).
Výskyt väčšiny chorôb, ktorým sa dá s pomocou očkovania zabrániť, je dnes blízko historického minima. Mnohé infekčné ochorenia sa nedokážu šíriť vtedy, keď je dostatočná časť populácie zaočkovaná. Napríklad pri osýpkach funguje tzv. kolektívna imunita vtedy, keď je zaočkovaných 19 z 20 ľudí. Kolektívna imunita je obzvlášť dôležitá pre ľudí, ktorí zo zdravotných dôvodov nemôžu byť očkovaní – pred prípadným ochorením ich chráni iba zaočkovanosť ľudí v ich okolí.
Technológia pre novú generáciu vakcín
V súčasnosti sa pri výrobe vakcín spomínajú dva prístupy, ktoré môžu zvýšiť ich bezpečnosť a účinnosť a vyvolávajú očakávania použitia vakcín aj pre nové typy ochorení. Ide o štrukturálnu vakcinológiu a syntetickú biológiu.
Štrukturálna vakcinológia ťaží najmä z možnosti 3D zobrazenia proteínov. Vďaka tomu môžu vedci presne nadizajnovať protilátku s lepšou imunitnou odpoveďou a ochranou. Tento prístup nadväzuje na reverznú vakcinológiu, ktorá využíva bioinformatiku a sekvenovanie genómov patogénov na identifikáciu takých génov obsiahnutých v patogénoch, ktoré by boli vhodnými cieľmi pre vakcíny. Schopnosť rozkľúčovať celý genóm patogénnych organizmov viedla k myšlienke využiť to aj k hľadaniu nových antigénov, ktoré by pri „tradičnom“ postupe ostali skryté. Reverzný prístup priniesol vakcínu proti meningokoku B, v testovaní sú aj vakcíny proti baktériám odolným voči antibiotikám.
Syntetická biológia pracuje s génovou syntézou – výrobou umelých génov v laboratóriu s veľmi malou chybovosťou. S využitím tejto technológie bolo možné v priebehu niekoľkých dní namiesto niekoľkých mesiacov vyrobiť vakcínu proti pandemickej chrípke.
Vakcíny, ktoré liečia
Aj vďaka vakcínam dnes lepšie rozumieme tomu, ako funguje imunitný systém. Vývoj v budúcnosti vakcín smeruje k tomu, že ich budeme môcť využívať na “cvičenie” imunitného systému nielen proti infekčným ochoreniam, ale aj nádorovým ochoreniam či závislostiam. Dnes ide stále skôr o koncept, ktorý sa postupne vyvíja a hľadajú sa cesty pre jeho praktickú realizáciu. Vzhľadom na demografický vývoj a neustále starnutie populácie to je práve staršia generácia (a pre ňu špecifické ochorenia), ktorá najviac potrebuje vývoj nových a lepších vakcín.
Vakcíny proti HPV a hepatitíde B významne prispievajú k prevencii rakoviny. V súčasnosti prebiehajú klinické skúšania pri viac ako desiatke rôznych typov rakoviny aj pre liečebné vakcíny. Tie sú navrhnuté tak, aby spomalili alebo zabránili rastu rakovinových buniek, zmenšovali nádory, zabránili opätovnému návratu rakoviny alebo eliminovali rakovinové bunky, ktoré v tele ostali po iných typoch liečby.
Dnes sa hovorí o dvoch hlavných druhoch terapeutických vakcín:
- špecifických podľa pacienta (vakcíny vyrobené z vlastných buniek alebo nádoru pacienta) alebo
- nešpecifických (vakcína vyvoláva imunitnú odpoveď proti konkrétnych antigénom, ktoré sa nachádzajú v tumore).
Liečebné vakcíny proti rakovine sa vyvíjajú už niekoľko desaťročí. Počiatočný výskum síce nepriniesol konkrétny liek, ale významne dopomohol k lepšiemu pochopeniu imunitnej antitumorovej odpovede a podnietil vývoj moderných imunoterapeutických prvkov, ktoré sú podstatne menej toxické ako bežná chemoterapia a cielené terapie. Vzhľadom na dnešný vývoj môžeme očakávať, že v blízkej budúcnosti bude možné očkovať ľudí pri dovŕšení určitej vekovej hranice a oddialiť tak viacero typov rakoviny na niekoľko rokov alebo aj navždy.
Zdroje:
1. Baschieri S.: Innovation in Vaccinology. Springer. 2012.
2. Finco O., Rappuoli R.: Designing vaccines for the twenty-first century society. Frontier in Immunology. 2014. doi: 10.3389/fimmu.2014.00012. (online)
3. Vaccines PNAS 100th Anniversary Special Feature. Proceedings of the National Academy of Sciences. 2014. (online)
4. WHO: Why tobacco is a public health priority. (online)
5. Pertinačová J.: Aktuálne poznatky o adjuvanciách v očkovacích látkach. Pediatria pre prax. 2014. (online)
6. Cornuz et al.: A Vaccine against Nicotine for Smoking Cessation: A Randomized Controlled Trial. PLOS. 2008. doi: 10.1371/journal.pone.0002547. (online)
7. Quenqua D.: An Addiction Vaccine, Tantalizingly Close. NYTimes. 2011. (online)
8. Pentel P.R., LeSage M.G.: New Directions in Nicotine Vaccine Design and Use. Advances in Pharmacology. 2014. doi:10.1016/B978-0-12-420118-7.00014-7. (online)
9. National Cancer Insitute – Cancer Vaccines. (online)
10. Bilusic M., Madan R.A.: Therapeutic Cancer Vaccines: The Latest Advancement in Targeted Therapy. PMC. DOI: 10.1097/MJT.0b013e3182068cdb. (online)
11. Ott G., Van Nest G.: DEVELOPMENT OF VACCINE ADJUVANTS: A HISTORICAL PERSPECTIVE. 2007. (online)
12. Jit M., Brisson M., Portnoy A.: Cost-effectiveness of female human papillomavirus vaccination in 179 countries: a PRIME modelling study. The Lancet. 2014. DOI: http://dx.doi.org/10.1016/S2214-109X(14)70237-2 (online)
13. Stern A.M., Markel H.: The History Of Vaccines And Immunization: Familiar Patterns, New Challenges. Health Affairs. 2005. DOI: 10.1377/hlthaff.24.3.611. (online)
14. The Science of Immunisation. Australian Academy of Science. 2012. (online)
15. Smith K.A.: Louis Pasteur, the Father of Immunology?. Frontier in Immunology. 2012. DOI: 10.3389/fimmu.2012.00068. (online)
16. Bonanni P., Santos J.I.: Vaccine evolution. Perspectives in Vaccinology. 2011. doi:10.1016/j.pervac.2011.05.001. (online)
17. Plotkin S.A.: History of Vaccine Development. Springer. 2011.
