Mnohopočetný myelóm
Prognóza pacientov s MM sa za posledné roky značne zlepšila. Vedci dnes riešia, ako tento pokrok využiť tak, aby sa ochorenie zmenilo pre všetky vekové kategórie na chronické a liečiteľné.
Thomasa Alexandera McBeana zdroje opisujú ako vysoko váženého londýnskeho obchodníka, ktorý mal 45 rokov, keď ochorel. Počas dovolenky si spravil výlet do podzemnej jaskyne a po východe z nej popisoval, že cítil „akoby niečo prasklo alebo povolilo v jeho hrudi“ a niekoľko minút ležal na zemi, nehybný od bolesti. Bolo to v lete 1844 a hoci sa dôkazy mnohopočetného myelómu dajú nájsť aj medzi archeologickými vykopávkami, T. A. McBean patrí medzi prvé veľmi dobre zdokumentované prípady tohto ochorenia.
McBeana sa ujali lekári, zatiaľ netušiaci čo s ním vlastne je, ktorí mu dočasne uľavili od bolesti. Tá sa vrátila na jar 1845 a jeho lekár, dr. Thomas Watson, mu predpísal železo a chinín, ktoré zvyčajne priniesli úľavu a rýchle zlepšenie. McBeanov stav sa opäť zhoršil na jeseň 1845, navštívil teda ordináciu dr. Williama Macintyrea. Lekárovi sa nepozdával moč pacienta, poslal ho preto na rozbor lekárovi Bence Jonesovi do Nemocnice Sv. Juraja. Jones potvrdil Macintyrove podozrenie a vypočítal, že pacient vylučoval viac ako 60 g proteínov denne. Podľa Jonesa išlo o oxid albumínu – proteínu, ktorý sa bežne nachádza v krvi, ale zdravá oblička ho dokáže odfiltrovať a do moču by sa dostať nemala.
McBeanove bolesti pokračovali a zomrel prvého januára 1846. Pitva ukázala, že jeho kosti boli mäkké, krehké a lámavé a obsahovali „rôsolovitú mazľavú látku krvavočervenej farby“. Histológia kostnej drene odhalila bunky okrúhleho a oválneho tvaru, ktoré boli až dvakrát väčšie ako priemerné krvné bunky a obsahovali jedno alebo dve jadrá a svetlé jadierko.
Čo je mnohopočetný myelóm
Dnes vieme, že Bence Jones bol vo svojej analýze veľmi presný. Mnohopočetný myelóm je nádorovým ochorením krvi, pri ktorom dochádza k nekontrolovanému množeniu abnormálnych plazmatických buniek. Tie neplnia svoju funkciu a nedokážu chrániť pred infekciami, nadmerným množením blokujú zdravú tvorbu krvi a ukladajú sa aj do iných orgánov.
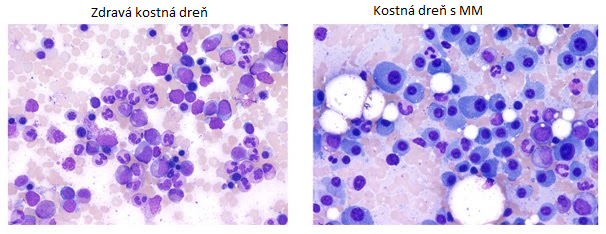
Koho sa MM týka
MM sa dvakrát častejšie vyskytuje u černochov ako u belochov a je častejší u pacientov, ktorí majú blízkeho príbuzného s týmto ochorením. Naznačuje to spojitosť s genetickými faktormi, ktoré môžu pri vzniku ochorenia hrať určitú úlohu.
Príčiny a rizikové faktory
Presné príčiny vzniku mnohopočetného myelómu stále nie sú známe. Vedcom sa podarilo určiť viacero rizikových faktorov zvyšujúcich pravdepodobnosť vzniku ochorenia:
- opakovaný kontakt s chemikáliami ako sú pesticídy alebo benzény;
- niekoľko štúdií poukazuje na spojitosť s vírusovými infekciami ako HIV;
- pacienti s Gaucherovou chorobou, dedičným ochorením trávenia, majú vyššie riziko vzniku MM.
Príznaky mnohopočetného myelómu
Mnohopočetný myelóm sa najčastejšie prejaví poruchou funkcie obličiek (ako to bolo vo vyššie opísanom prípade Thomasa Alexandera McBeana), útlmom krvotvorby a bolesťou kostí. Myelóm môže zasiahnuť aj viaceré oblasti tela naraz.
Pacienti neraz trpia aj opakovanými infekciami. Ani očkovacie látky na nich neúčinkujú tak ako na zdravých. Chorí často pociťujú únavu, jednak zo samotného ochorenia, ale aj pre pokles červených krviniek.
Mnohopočetný myelóm často zapríčiňuje poškodenie kosti (zvyčajne v oblasti lebky, chrbtice, rebier, panvy alebo v dlhých kostiach), čo spôsobuje riziko patologických zlomenín. Zriedkavejšie sa objavuje osteoporóza.
Nádorové plazmatické bunky produkujú nefunkčnú protilátku nazývanú paraproteín. Vysoká hladina paraproteínu spôsobuje poruchu zrážania krvi a ovplyvňuje normálne funkcie krvných doštičiek. To sa môže prejaviť krvácaním z nosa a tvorbou modrín. Vysoká hladina paraproteínu v krvi sa prejavuje aj poruchami videnia, bolesťami hlavy, poruchou srdcovej činnosti či poruchou dýchania.
Keď sa z kostí vplyvom myelómu uvoľňuje nadmerné množstvo vápnika, nastáva hyperkalciémia, ktorá sa považuje za závažnú metabolickú poruchu. Prejavuje sa zápchou, celkovou vyčerpanosťou, ospanlivosťou až dezorientáciou, nadmerným močením a sústavným smädom. Pacient má byť ihneď hospitalizovaný, lebo je ťažko dehydratovaný a v metabolickom rozvrate.
Juraj Chudej - lekár - lekár: Čo je mnohopočetný myelóm a ako prebieha diagnostika pacientov?
Diagnostika: Ako včas určiť MM
Skorá diagnostika je kľúčová pre nasadenie vhodnej liečby mnohopočetného myelómu. Ak sa ochorenie odhalí príliš neskoro, hrozí, že pacienti budú mať trvalo poškodené napríklad stavce, obličky či miechu. V minulosti boli bežné prípady, kedy pacienti neboli roky správne diagnostikovaní. Aj preto je doterajší a budúci vývoj v diagnostických metódach pre pacientom s MM veľmi dôležitý.
Pribúdajúce poznatky o ochorení a nové technologické možnosti prispievajú k tomu, že každá z diagnostických metód prechádza vývojom a hľadajú sa nové cesty, ako diagnostiku urýchliť. Pre diagnostikovanie mnohopočetného myelómu je potrebných zvyčajne viacero špecializovaných vyšetrení, ktoré presne, rozhoduje lekár:
- Testy krvi a moču: Myelómové bunky často vylučujú protilátky nazývané „M proteín“. Množstvo M proteínu v krvi a moči slúži ako indikátor rozsahu ochorenia a pôsobenia liečby. Okrem toho sa v krvi sledujú aj množstvá protilátok IgG, IgA a IgM.
- Röntgen (RTG): RTG kostí je zvyčajne prvým testom pri podozrení, že pacient má MM.
- Magnetická rezonancia (MRI): MRI vie odhaliť, čo sa deje vnútri kostí – či už nedošlo k nahradeniu kostnej drene myelómovými bunkami.
- Počítačová tomografia (CT): CT vytvára detailný obraz, ktorý ukazuje abnormality v mäkkom tkanive. Výsledkom je 3D pohľad celého vnútra.
- Pozitrónová tomografia (PET): PET sken vytvára obraz orgánov a tkanív vnútri tela. Pacient dostane injekciu s malým množstvom rádioaktívnej glukózy, ktorú spotrebujú bunky využívajúce najviac energie. Keďže rakovinové bunky zvyčajne aktívne využívajú energiu, spotrebujú aj viac rádioaktívnej látky.
- Integrovaný PET-CT: Kombinujú obrazy z PET skenu a CT, ktoré sú vykonané v rovnakom čase rovnakým prístrojom. Výsledkom je kompletnejší obraz, ktorý sa nedá dosiahnuť jediným zariadením.
- Biopsia kostnej drene: Preskúmanie vzoriek kostnej drene patológom je dôležité pre spoľahlivé určenie diagnózy MM.
- Molekulárne testy: V niektorých prípadoch môže lekár odporučiť testovanie vzoriek nádoru na prítomnosť špecifických chromozómov, génov alebo proteínov. Tieto výsledky pomáhajú pri optimálnom nastavení liečby.
Juraj Chudej - lekár: Čím prechádza pacient po určení diagnózy a ako sa rozhoduje o liečbe?
Štádiá ochorenia: Lepšie rozumieme, čo sa pri MM deje
Správne určenie štádia ochorenia je pre liečbu kľúčové – štádium lekárovi hovorí, ako sa už ochorenie rozšírilo a napovedá, ako sa môže vyvíjať ďalej. Podľa toho lekár určuje prognózu pacienta. Systém určovania štádií rakoviny berie do úvahy, ako sa už ochorenie rozšírilo a do akej miery už zasiahlo orgány alebo tkanivo.
Aj systémy určovania štádií sa postupne menia a ukazujú na pokrok v tom, ako veda ochoreniu rozumie. V prípade mnohopočetného myelómu sa používa viacero prístupov, dva sú najrozšírenejšie. Prvý pochádza ešte z roku 1975, označuje sa Durie-Salmon systém. Táto klasifikácia znamenala medicínsky posun v diagnostike MM. Postavená je na niekoľkých testoch, ktoré sledovali:
- množstvo paraproteínu v krvi a/alebo moči: veľké množstvo paraproteínu naznačuje prítomnosť veľkého počtu abnormálnych plazmatických buniek, ktoré produkujú tento abnormálny proteín;
- množstvo vápnika v krvi: veľké množstvo vápnika je spojené s pokročilým ochorením;
- množstvo červeného krvného farbiva: nízka hladina hemoglobínu zvyčajne ukazuje na veľké množstvo myelómových buniek v kostnej dreni alebo na obmedzené fungovanie obličiek spôsobené myelómom;
- množstvo kostných lézií: počet poškodení kostí rastie s postupom ochorenia;
- fungovanie obličiek: obmedzené fungovanie obličiek je bežná komplikácia pri MM.
Podľa hodnôt v jednotlivých testoch lekári rozdelia pacientov do troch štádií, každé môže byť ešte rozdelené do podštádií, označovaných ako typ A (relatívne normálne fungovanie obličiek) a B (nedostatočná funkcia obličiek so zadržiavaním dusíkatých látok).
Hoci sa Durie-Salmon systém stále využíva, v roku 2003 boli vyvinuté nové diagnostické kritériá nazývané ISS (International Staging System). Tieto berú do úvahy niektoré dôležité prognostické faktory, ktoré neboli v časoch Durie-Salmon známe. ISS vychádza z laboratórnych testov jednoduchého odberu krvi. Testuje sa množstvo proteínu s názvom beta-2 mikroglobulínu (B2M) a proteínu s názvom albumínu. Podľa týchto hodnôt sú pacienti rozdelení do troch štádií.
Liečba MM: Od ožarovania k novým molekulám
Liečba mnohopočetného myelómu prešla od čias Thomasa Alexandera McBeana a predpisovania chinínu radikálnym posunom. Napriek tomu, že stále ide o nevyliečiteľné ochorenie, posun v diagnostike a liečbe umožňuje dnešným pacientom žiť dlhší a kvalitnejší život.
K prvej chemoterapii
Do konca 40. rokov 20-teho storočia bola rádioterapia jediná účinná metóda pri liečbe nádorov plazmatických buniek. V roku 1947 predstavil švédsky lekár Nils Alwall liečbu uretánom. Ide o organickú zlúčeninu, ktorá sa v malých množstvách nachádza aj v chlebe, niektorých druhoch ovocia či víne. Pacient liečený uretánom vykazoval v Alwallových testoch zlepšenia a táto liečba sa stala štandardom na najbližších 15 rokov. Neskoršie placebom kontrolované štúdie rozdiel medzi placebom a uretánom nezistili.
Dôležité objavy nasledovali na prelome 50. a 60. rokov, kedy tímy zo Sovietskeho zväzu (v roku 1958) a USA (1962) potvrdili zlepšenie u pacientov liečených cytostatikami – išlo teda o základ chemotereapeutickej liečby MM. Použité boli alkylačné látky, ktoré poškodzujú štruktúru nukleových kyselín (DNA a RNA – nositelia genetických informácií bunky) v nádorových bunkách. Prakticky v rovnakom čase boli publikované prvé štúdie potvrdzujúce aj účinok steroidov pri liečbe mnohopočetného myelómu. Tieto látky znižujú zápal v tele, no zároveň oslabujú imunitný systém. V nasledujúcich rokoch sa ako účinné ukazovali aj kombinácie rôznych alkylačných látok a kombinácie týchto látok s liečbou steroidmi. Nasledujúce desaťročia boli práve takéto kombinácie základom liečby pacientov s MM.
Ako vymeniť kostnú dreň
Liečbe mnohopočetného myelómu významne dopomohol aj americký chemik a lekár Edward Donnall Thomas, hoci na niečo také na začiatku svojej vedeckej cesty možno ani nepomyslel. Thomas je považovaný za otca transplantácie kmeňových buniek kostnej drene, ktorá je dnes jednou z najefektívnejších liečebných stratégií MM pre vhodných pacientov. Thomasova práca na úspešnom prevedení transplantácie sa začala v päťdesiatych rokoch, v roku 1990 za ňu dostal Nobelovu cenu.
Prví pacienti skúšali u Thomasa transplantáciu kostnej drene už v roku 1957, celý proces popísal v štúdii publikovanej v The New England Journal of Medicine. Išlo o alogénnu transplantáciu – príjemca teda dostal kostnú dreň od iného darcu. Šiesti pacienti boli ožarovaní a podstúpili liečbu chemoterapiou, následne dostali vnútrožilovo dávku kostnej drene od zdravého darcu. Hoci zákrok nevyvolal žiadne vážne nežiaduce účinky, iba u dvoch pacientov sa ukázal pozitívny účinok a žiaden pacient neprežil viac ako 100 dní. Nasledujúce testy taktiež neprinášali pozitívne výsledky, pesimizmus o možnosti realizovať transplantáciu začal silnieť.
Napriek tomu, že viacero výskumníkov opustilo skúmanie transplantácie kostnej drene, Thomas pokračoval. Po ďalšom testovaní na zvieratách usúdil, že pre uchytenie darovanej drene je podstatný správny výber darcu. V roku 1969 začal spolu s tímom klinické testovanie alogénnej transplantácie na vyhovujúcich súrodencoch, z ktorých jeden mal rozvinutú leukémiu. Väčšina pacientov zomrela na leukémiu alebo súvisiace komplikácie, u niekoľkých ale došlo k vymiznutiu ochorenia. O desať rokov neskôr už Thomasov tím hlásil 50 % úspech transplantačnej liečby pre pacientov s akútnou myeloidnou lekémiou. V roku 1982 prišla prvá úspešná transplantácia kmeňových buniek u pacienta s myelómom.
Prvá štúdia o vysokodávkovanej chemoterapii s následnou transplantáciou vlastných kmeňových buniek pacienta bola publikovaná v roku 1987 a neskôr sa stala súčasťou štandardu liečby MM.
Éra nových molekúl
Koniec deväťdesiatych rokoch priniesol začiatok novej éry liečby pacientov s MM. Najskôr sa ukázalo vhodné využitie imunomodulačných liekov v liečbe. Ide o látky, ktoré vplývajú na fungovanie imunitného systému. Prvá, ktorá sa začala používať pri liečbe MM, bola vedcom známa už od konca šesťdesiatych rokov. Vtedajšie testy sledujúce užívanie lieku pacientmi s rakovinou ale nepriniesli jednoznačné závery. O desaťročie neskôr už ale vedci prišli na to, že šírenie a rast krvných vlásočníc (jemné cievy spájajúce tepny a žily) úzko súvisí s rozširovaním pevných nádorov.
Začiatkom 90. rokov na to výskum nadviazal s poznaním, že to isté platí aj pre rakoviny krvi. A liek, ktorý bol objavený pred takmer 50 rokmi je práve z tých, ktoré potláčajú rast nových vlásočníc. V pilotnom testovaní 32 % pacientov (z celkovo 84) pozitívne reagovalo na tento liek. Výskum bol publikovaný v roku 1999, išlo o prvý samostatne pôsobiaci liek s antimyelomovým účinkom po tridsiatich rokoch.
O 5 rokov neskôr na tento prelom nadviazal nový liek zo skupiny inhibítorov proteazómov. Fungujú tak, že blokujú pôsobenie proteazómov – bunkových štruktúr, ktoré rozkladajú bielkoviny. V prípade niektorých rakovín sa bielkoviny, ktoré za normálnych okolností zneškodnia rakovinové bunky, rozložia príliš rýchlo. Lieky z tejto skupiny narúšajú tento proces a umožňujú bielkovinám zlikvidovať rakovinové bunky. Nové lieky z týchto skupín dramaticky zmenili prognózu pacientov.
Štúdia na 1038 pacientoch diagnostikovaných medzi rokmi 2001 a 2010, ktorá porovnávala výsledky tradičnej a novej liečby, ukázala, že za zlepšenie v prežívaní u starších pacientov vďačíme liečbe novými liekmi. Výzvou podľa štúdie stále zostávajú mladší pacienti.
Hoci nové druhy liečby priniesli zlepšenie trendu prežívania pacientov s myelómom, ochorenie stále ostáva nevyliečiteľné. Účinnejšie lieky a postupy, vrátane liekov nových skupín a nových druhov liečby v už existujúcich triedach, sú preto naliehavo potrebné.
Skupina nových molekúl sa pred pár rokmi rozšírila ešte o liek zo skupiny monoklónových protilátok. Ide o proteíny, ktoré sa vedia naviazať na proteíny nádorovej bunky a po naviazaní aktivujú vlastný imunitný systém hostiteľa (pacienta). To vedie k zabitiu nádorovej bunky. Niektoré protilátky sú úplne ľudské (humánne). Lieky z tejto skupiny pre pacientov s MM boli v roku 2016 schválené na použitie v EÚ.
Len prednedávnom pribudlo nové liečivo zo skupiny inhibítorov históndeacetylázy. Históndeacetylázy (HDAC) sú enzýmy, ktoré sú kľúčové pre bunkové procesy, ako sú prežitie, proliferácia a diferenciácia. Ide o účinný inhibítor s epigenetickým efektom, ktorý zvyšuje citlivosť pacienta k inhibítoru proteazómov a ďalším terapiám MM a predlžuje prežívanie bez progresie u pacientov s mnohopočetným myelómom, ktorí dostali aspoň jednu predošlú terapiu.
Ako prebieha liečba dnes
Juraj Chudej - lekár: Čo priniesol pokrok v diagnostike a liečbe pacientom?
V liečbe MM neexistuje jeden postup predpísaný pre všetkých pacientov. Aj vďaka pokrokom popísaným vyššie dnes výber liečby lekárom závisí na niekoľkých faktoroch ako je stav pacienta, laboratórne výsledky, štádium ochorenia, vek, symptómy a podobne. Cieľom liečby mnohopočetného myelómu je:
- zlikvidovať myelómové bunky a predísť poškodeniu orgánov,
- znižovať rast tumoru a predĺžiť prežívanie bez ochorenia,
- znižovať bolesť a iné symptómy,
- umožniť pacientom žiť dobrý a aktívny život.
Po kompletnej diagnostike a zhodnotení stavu pacienta určí hematológ klinické štádium a typ myelómu. Na základe toho rozoznávame dve základné skupiny:
1. Bezpríznakový (asymptomatický) MM sa nelieči chemoterapiou. Ide o pacientov v skorom štádiu ochorenia bez príznakov, bez nepriaznivých prognostických ukazovateľov alebo s tlejúcim myelómom. Tí sú lekárom sledovaní asi raz za tri alebo štyri mesiace, prípadne dostávajú podpornú liečbu na zlepšenie kostného metabolizmu. Takýto postup sa nazýva aktívne monitorovanie. S liečbou sa začína, keď myelóm pokročí alebo keď sa objavia symptómy. Výskumy ukázali, že predčasné zahájenie liečby u týchto pacientov nevedie k predĺženiu ich prežívania a nie je prínosné. Naopak, spôsobuje zbytočné vedľajšie účinky a zhoršuje kvalitu života.
2. Príznakový (symptomatický) MM sa lieči podľa veku – do 65 rokov sa pacient zaraďuje do kategórie junior, nad 65 rokov senior. Pacienti s myelómom absolvujú v tejto fáze liečbu, ktorá je vo väčšine prípadov tvorená kombináciou viacerých liekov, vrátane cytostatík. Cieľom je zničiť čo najviac nádorových plazmatických buniek v tele. Hematológ môže rozhodnúť, že pacient je vhodný na transplantáciu kostnej drene a bude sám sebe darcom.
Počas liečby a po jej ukončení lekár vyšetrí krv, moč a kostnú dreň. Na základe výsledkov vyhodnotí efekt liečby. V prípade, že ochorenie ďalej postupuje alebo došlo po čase k zhoršeniu stavu, môže špecialista nasadiť iné lieky, najčastejšie sa jedná o lieky zo skupiny imunomodulačných látok alebo alebo inhibítorov proteazómu. Takéto kombinácie dnes prinášajú pacientom v relapse výsledky, ktoré sa bežne dosahovali iba pri novodiagnostikovaných prípadoch. Každý nový účinný liek môže priniesť plus jeden rok v mediáne celkového prežívania.
Čo môže v liečbe prísť
Juraj Chudej - lekár: Ako môže vyzerať budúcnosť liečby MM?
rognóza pacientov s mnohopočetným myelómom sa za posledné roky značne zlepšila. Vedci dnes riešia, ako tento pokrok priniesť pre všetky vekové kategórie pacientov s MM tak, aby sa ochorenie zmenilo pre všetkých zo smrteľného na chronické a liečiteľné. V klinickom testovaní je niekoľko nových liekov a prístupov k liečbe, ktoré by to mohli v najbližších rokoch priniesť:
- Nové génové ciele: Výskum venuje veľkú pozornosť identifikácii genetických zmien súvisiacich s vyšším rizikom rozvinutia ochorenia. Nedávna štúdia odhalila osem nových takýchto zmien, čo podľa jej autorov znamená ďalší dôkaz o (aspoň čiastočnej) dedičnosti genetickej predispozície pre MM. Lepšie pochopenie toho, čo stojí za vznikom ochorenia, znamená aj budúci vývoj lepšie fungujúcich liekov.
- Nové kombinácie a režimy liečby: Liečba kombináciou liekov s rôznym mechanizmom pôsobenia dáva lekárom viac možností liečbu prispôsobiť potrebám konkrétneho pacienta. Niektoré nové liečebné kombinácie sa ukazujú ako správna cesta pri zvyšovaní prežívania bez toho, aby rástla aj toxicita liečby.
- Lepšie predvídanie výsledkov: Zlepšovanie možností presnejšie predpovedať reakciu pacienta na liečbu sa stáva dôležitou súčasťou výskumu. Biomedicínsky výskum sa zameriava na to, aby priniesol technológie, ktoré zjednodušia liečbu a budú ju vedieť ušiť na mieru pacienta.
Kde hľadať pomoc
Slovenská myelómová spoločnosť (SmyS)
Združenie pacientov s hematologickými malignitami
Zdroje:
Appelbaum, F. R. (2007). Hematopoietic-Cell transplantation at 50. New England Journal of Medicine, 357(15), 1472–1475. doi:10.1056/nejmp078166
Ballová, V. (2007). Mnohopočetný myelóm – diagnostika a liečba pre praktického lekára. Retrieved from http://www.viapractica.sk/index.php?page=pdf_view&pdf_id=2497&magazine_id=1
HINARI (2011). Nature outlook: Multiple Myeloma. . Retrieved from http://www.nature.com/nature/outlook/multiple_myeloma/
Kumar, S., Dispenzieri, A., Lacy, M., Gertz, M., Buadi, F., Pandey, S., … Rajkumar, S. (2013). Continued improvement in survival in multiple myeloma: Changes in early mortality and outcomes in older patients. Leukaemia., 28(5), 1122–8. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/24157580
Kyle, R. A. (2005). Leukaemia – abstract of the article: Five decades of therapy for multiple myeloma: A paradigm for therapeutic models. Leukaemia, 19(6), 910–912. doi:10.1038/sj.leu.2403728
Kyle, R. A., & Rajkumar, V. S. (2008). Multiple myeloma. , 111(6). Retrieved from http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2265446/
Kyle, R. A., & Steensma, D. P. (2011). History of multiple Myeloma. In Recent Results in Cancer Research (pp. 3–23). doi:10.1007/978-3-540-85772-3_1
Multiple Myeloma: Diagnosis. (2015, July 28). Retrieved July 28, 2016, from http://www.cancer.net/cancer-types/multiple-myeloma/diagnosis
Staging of myeloma. (2010). . Retrieved from http://www.nhs.uk/ipgmedia/national/myeloma%20uk/assets/stagingofmyeloma(myelomauk4pages).pdf
Three new therapies approved for Multiple Myeloma. (2016, January 6). Retrieved July 28, 2016, from http://www.cancer.gov/news-events/cancer-currents-blog/2016/fda-threedrugs-myeloma

