Fibrilácia predsiení
Fibrilácia predsiení môže viesť k vytvoreniu krvných zrazenín v srdci a tieto môžu potom putovať zo srdca až do mozgu, kde upchajú niektorú s mozgových artérii.
Čo je fibrilácia predsiení
Fibrilácia predsiení (FiP) je porucha srdcového rytmu (arytmia) charakterizovaná nekoordinovanou, rýchlou a nepravidelnou elektrickou aktiváciou a kontrakciou predsiení srdca, pričom nepravidelnosť sa prenáša aj na kontrakciu srdcových komôr. Odhaduje sa, že v Európe trpí na FiP až 3% dospelej populácie1. FiP tak predstavuje najčastejšie sa vyskytujúcu arytmiu v klinickej praxi. Ak sa na to pozrieme z inej perspektívy, približne u každého štvrtého človeka vo veku 40-55, doteraz bez FiP, dôjde v priebehu ďalšieho života k rozvoju tohto ochorenia. (2,3)
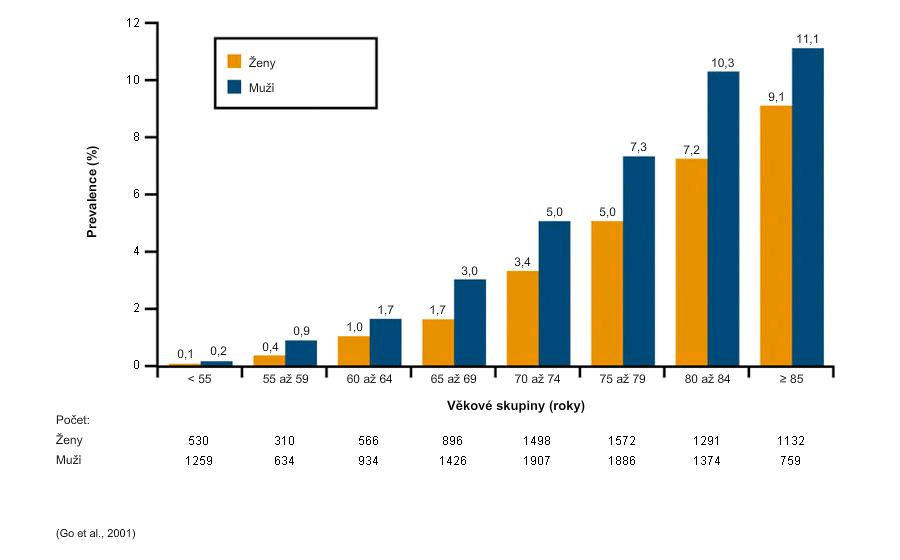
FiP sa často vyskytuje predovšetkým u starších osôb a pri starnutí populácie je výskyt tohto ochorenia stále častejší. (40,41,42,43,44) Presné hodnoty prevalencie sa medzi štúdiami odlišujú, pravdepodobne v dôsledku rozdielov v dizajne štúdií alebo skúmaných populácií. Uvádzané hodnoty celkovej incidencie sa pohybujú od 1 do 10 prípadov FiP na 1000 pacient-rokov.(42,3) Celoživotné riziko rozvoja FiP u mužov 1,5-násobne vyššie než u žien (46). Frekvencia výskytu FiP stúpa s vekom a jeho prevalencia môže byť ≥ 10 % u osôb vo veku ≥ 85 rokov.
Prevalencia FiP podľa veku a pohlavia v štúdii ATRIA (40):
Významnými rizikovými faktormi pre vznik FiP sú najmä hypertenzia, chronické srdcové zlyhávanie., hypertrofia (zhrubnutie svaloviny stien ľavej komory), infarkt myokardu, ochorenia srdcových chlopní a cukrovka – diabetes mellitus. FiP môže súvisieť tiež s obezitou, hypertyreózou, nadmernou konzumáciou alkoholu a aktívnym zápalovým procesom v organizme.
Klasifikácia FiP
FiP možno podrobnejšie klasifikovať a charakterizovať na základe rôznych kritérií (1). Užitočné je rozlíšenie primárnej a sekundárnej FiP: primárna FiP vzniká bez zjavnej bezprostrednej vyvolávajúcej príčiny, sekundárna FiP je spôsobená akútnou a potenciálne upraviteľnou, zväčša extrakardiálnou (mimosrdcovou) príčinou, napríklad zvýšenou funkciou štítnej žľazy – hypertyreózou (23).
Ďalšou možnosťou rozlíšenia je delenie na FiP s chlopňovou chybou (valvulárna FiP – typicky pri zúžení (stenóze) mitrálnej chlopne) a bez chlopňovej chyby (non-valvulárna FiP). FiP bez chlopňovej chyby tvoria prípady bez reumatického postihnutia mitrálnej chlopne, bez náhrady srdcovej chlopne alebo jej chirurgickej úpravy (plastiky) (1). Pre účely klinického rozhodovania je však FiP primárne klasifikovaná podľa doby jej trvania (1,13). Platné odporúčania Európskej kardiologickej spoločnosti (ESC) pre liečbu FiP boli uverejnené v roku 2010 a definujú nasledujúcich päť typov FiP pre potreby klinickej praxe (13)
Klasifikácia FiP podľa ESC (13):

1. Prvá zdiagnostikovaná FiP: za pacienta s prvým zdiagnostikovaným záchvatom FiP je považovaný každý pacient, u ktorého je po prvýkrát zistená FiP, ktorá je následne klasifikovaná ako jeden z nasledujúcich typov:
2. Paroxyzmálna (záchvatovitá) FiP: táto FiP spontánne skončí, zvyčajne do 48 hodín. Po 48 hodinách je pravdepodobnosť spontánnej normalizácie srdcového rytmu nízka a je potrebné zvážiť antikoagulačnú liečbu.
3. Perzistujúca FiP: trvá dlhšie ako 7 dní a je potrebné ju ukončiť farmakologickou alebo priamou elektrickou kardioverziou.
4. Dlhodobo perzistujúca FiP: trvá dlhšie než 1 rok aj pri zahájení liečby na kontrolu srdcového rytmu
5. Permanentná FiP: je stav, kedy pacient (aj lekár) akceptuje existenciu FiP a neužíva žiadnu liečbu na kontrolu srdcového rytmu. Ak začne pacient s FiP užívať liečbu na kontrolu srdcového rytmu, je FiP preklasifikovaná na dlhodobo perzistujúcu FiP. U mnohých pacientov časom dochádza k progresii ochorenia z jednej kategórie do kategórie závažnejšej.
Všeobecne sa dá povedať, že FiP progreduje cez štádiá paroxyzmálnej a perzistujúcej FiP zvyšovaním počtu a predlžovaním doby trvania epizód FiP. Recidívy paroxyzmálnej FiP nevznikajú v náhodných intervaloch, skôr sa vyskytujú v klastroch (30). Riziko recidívy sa odhaduje na 10% v prvom roku po výskyte príznakov a 5% ročne v nasledujúcich rokoch (13). Všetky uvedené typy FiP sa môžu vyskytovať ako „tiché“ (bezpríznakové, asymptomatické).
Mortalita a výskyt závažnejších príhod dosahuje u pacientov s asymptomatickou FiP podobné hodnoty ako u pacientov so symptomatickou FiP (32). Je dôležité, aby boli diagnostikované a liečené obe formy FiP, prechodná aj trvalá. Asymptomatickú FiP je možné diagnostikovať po vzniku komplikácií (napr. po cievnej mozgovej príhode) alebo na základe náhodne natočeného EKG (13).
Prečo je FiP nebezpečná?
FiP môže viesť k vytvoreniu krvných zrazenín v srdci a tieto môžu potom putovať zo srdca až do mozgu, kde upchajú niektorú s mozgových artérii čím spôsobia ischemickú cievnu mozgovú príhodu s mozgovým infarktom. Tá predstavuje najčastejší typ CMP – cievnej mozgovej príhody a zapríčiňuje približne 85-87% cievnych mozgových príhod (4). FiP oproti zdravej populácii zvyšuje riziko CMP približne 5-násobne a je príčinou 15-25% všetkých ischemických cievnych mozgových príhod (4,5).
U cievnych mozgových príhod spojených s FiP je taktiež vyššia pravdepodobnosť fatálnych následkov, invalidity a recidívy než u cievnych mozgových príhod, ktoré s FiP nesúvisia (6,7,8,9,10,11,12). FiP môže tiež spôsobiť tromboembolické komplikácie v periférnom artériovom riečisku. Dlhodobo perzistujúca FiP môže viesť k obrazu zlyhávania srdca vo forme tzv. tachykardiomyopatie. Iným typom CMP sú hemoragické cievne mozgové príhody, ktoré predstavujú približne 13-15% cievnych mozgových príhod a vznikajú v dôsledku ruptúry (prasknutia) krvnej cievy v mozgu.
K ischemickej cievnej mozgovej príhode dochádza pri prerušení zásobovania mozgu krvou, následkom čoho vzniká mozgová ischemia (62). Cievna mozgová príhoda je všeobecne považovaná za úplnú, ak ischémia trvá > 24 hodín (62). Mozog je extrémne citlivý na nedostatok kyslíka a preto prerušenie zásobovania čo i len na pár minút môže viesť k odumretiu postihnutej oblasti mozgového tkaniva.
Vznik ischemickej cievnej mozgovej príhody: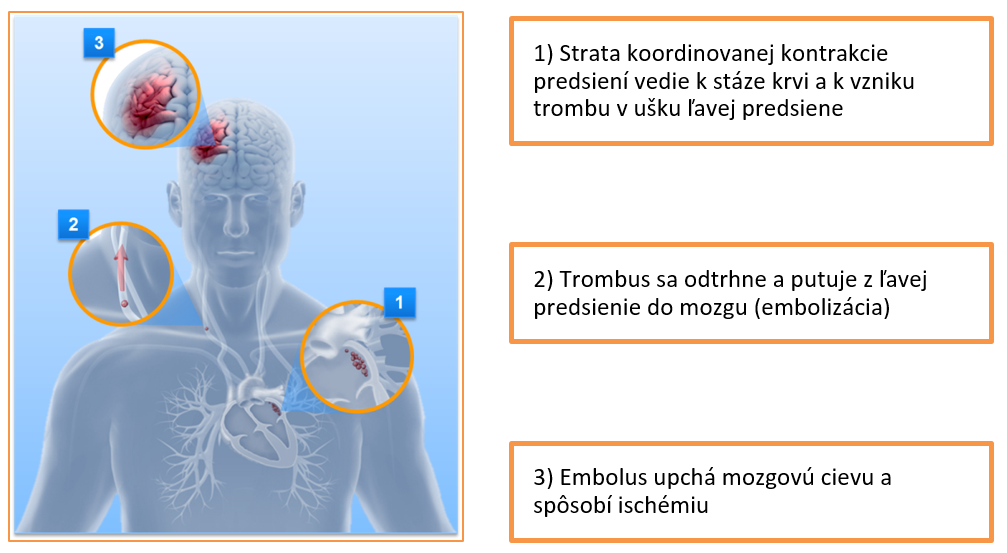
V prípade, že embolus uzavrie tepnu, označujeme oblasť, v ktorej došlo k odumretiu tkaniva (infarktu) ako jadro ischémie.63 V okolí jadra ischémie sa nachádza funkčne postihnuté, ale štrukturálne stále intaktné tkanivo, nazývané ischemická penumbra (polotieň) (63).
Toto tkanivo je možné zachrániť, ak je liečba poskytnutá dostatočne rýchlo (63). Neuróny nemajú žiadnu zásobu energie, sú teda úplne závislé na trvalom prísune glukózy a kyslíka z krvi a rýchlo sa u nich prejaví energetický deficit (63). Tento stav spúšťa kaskádu neurochemických dejov, ktoré môžu viesť k rýchlej bunkovej smrti v jadre ischémie a po určitom čase aj v ischemickej penumbre (70,63).
Prvým hlavným príznakom ischemickej cievnej mozgovej príhody je akútny nástup nebolestivého, fokálneho neurologického deficitu (71). Miera dysfunkcie závisí primárne na lokalizácii postihnutých oblastí mozgu a len sekundárne od rozsahu infarktu (71). Ako možno rýchlo rozpoznať príznaky cievnej mozgovej príhody je zhrnuté v schéme, ktorá vychádza z anglickej skratky FAST.
Ako rýchlo rozpoznať príznaky cievnej mozgovej príhody:
1 – paréza n. facialis; 2 – slabosť hornej končatiny; 3 – porucha reči (dysartria); 4 – čas na transport – rýchlo
Následky cievnej mozgovej príhody sa u jednotlivých pacientov výrazne líšia, ale môžeme hovoriť o: (73,64,4)
- úmrtí,
- ochrnutí (paralýze, zvyčajne jednej celej strany tela, ktorá je protiľahlá k strane, kde došlo k poškodeniu mozgu ischémiou,
- strate alebo poruche reči,
- strate zraku alebo rozmazanom videní,
- strate pamäte,
- poruche osobnosti alebo emocionálnych poruchách.
Z pacientov s diagnostikovanou FiP zomrie do 1 roku približne 30% pacientov na cievnu mozgovú príhodu (71). Približne 15-30% pacientov, ktorí prežijú cievnu mozgovú príhodu, zostáva trvale invalidnými (71). Ako už bolo uvedené, cievne mozgové príhody v dôsledku FiP vedú k invalidite častejšie než cievne mozgové príhody spôsobené inými príčinami a taktiež častejšie recidivujú (7,6,9,8,72). Mnoho pacientov, ktorí prežili cievnu mozgovú príhodu, nedokážu vykonávať bežné denné činnosti (napr. umyť sa, najesť sa, obliecť sa) a mnohí z nich trpia psychickými zdravotnými problémami (64). Cievna mozgová príhoda je druhou najčastejšou príčinou demencie (73).
Súčasne je aj druhou najčastejšou príčinou úmrtia v Európskej únii, každoročne na ňu umiera takmer 490 000 osôb. Mortalita v dôsledku prekonanej cievnej mozgovej príhody je vysoká. V EU zomrie na cievnu mozgovú príhodu približne jeden z desiatich mužov (9%) a jedna z ôsmich žien (13%). Odhaduje sa, že priame náklady na zdravotnú starostlivosť súvisiacu s cievnou mozgovou príhodu pr3edstavovali v EU v roku 2003 21,3 miliardy eur a ďalších 12,8 miliardy eur predstavovali nepriame náklady v dôsledku straty produktivity a ďalšej starostlivosti (77). Celkové ekonomické náklady na cievnu mozgovú príhodu podľa iného odhadu predstavovali v EU v roku 2006 viac než 38 miliárd eur (64)
Klinické prejavy a diagnostika FiP
Klinické prejavy FiP sú značne variabilné. U niektorých pacientov, t.j. tých s tichou (asymptomatickou) FiP, sa žiadne príznaky nevyskytujú. U týchto pacientov je FiP diagnostikovaná náhodne, napríklad pri rutinnom vyšetrení EKG alebo počas hospitalizácie, napr. z dôvodu infarktu myokardu alebo cievnej mozgovej príhody (23,13). Odhaduje sa, že asymptomatických pacientov je 10-40% (34,35). U pacientov, u ktorých sa spočiatku príznaky vyskytujú, môžu častom tieto príznaky vymiznúť, ak sa arytmia stane permanentnou. Tento vývoj je častý u starších osôb (34,35).
Medzi časté príznaky FiP patrí úzkosť, palpitácie, dýchavica, závrat, bolesti na hrudi, epizodická alebo zhoršujúca sa slabosť a únava (36,1,23). Vzhľadom k uvoľňovaniu atriálneho natriuretického peptidu sa môže vyskytnúť tiež polyúria, a to predovšetkým na začiatku alebo konci epizód(1). U niektorých pacientov sa môžu prejaviť závažné príznaky, vrátane srdcového zlyhania, hemodynamického kolapsu alebo cievnej mozgovej príhody (28,1). Tieto príznaky sú považované za následok hemodynamickej poruchy spôsobenej stratou systolickej funkcie predsiení a nepravidelnou odpoveďou komôr (28,36).
Hemodynamické abnormality zahŕňajú stratu koordinovanej kontrakcie predsiení, vysokú frekvenciu kontrakcií komôr, poruchu diastolického plnenia, nepravidelný srdcový rytmus a bradykardiu (36,23). Pri fyzikálnom vyšetrení pacientov s FiP je typickým nálezom nepravidelný periférny pulz, nepravidelná pulzácia jugulárnych žíl s chýbajúcou vlnou P a zmenami prvej srdcovej ozvy (21,28).
Diagnostický postup pri FiP zahŕňa: (1,13)
- anamnézu a fyzikálne vyšetrenie,
- 12-zvodový EKG záznam,
- laboratórny rozbor krvi zameraný na zistenie možných príčin FiP.
Pri úvodnom hodnotení klinického stavu pacienta s podozrením na FiP je potrebné zohľadniť viaceré aspekty: (1 13)
- Podrobná anamnéza.
- Klasifikácia FiP: je dôležitá, pretože podmieňuje stanovenie iniciálnej liečby a indikovanie ďalších diagnostických vyšetrení, napríklad transezofageálnej echokardiografie (TEE).
- Vyhodnotenie závažnosti príznakov spojených s FiP: ESC odporúča používať skóre vypracované združením European Heart Rhythm Association (EHRA). (30 13) • Odhad rizika vzniku cievnej mozgovej príhody (CHA2DS2-VASc skórovací systém pre stratifikáciu rizika CMP).
- Pátranie po príčinách FiP: medzi dôležité vyšetrenia patrí funkčný test štítnej žľazy, kompletný krvný obraz, stanovenie koncentrácie kreatinínu v sére, proteinúria, krvný tlak a glykémia nalačno. U niektorých pacientov je potrebné zvážiť vyšetrenie pečeňových funkcií. Záťažový test je možné použiť u pacientov so známkami ischemickej choroby srdca alebo prítomnosťou jej rizikových faktorov.
- Vyhodnotenie príznakov akútneho srdcového zlyhania.
- Vyhodnotenie potenciálnych komplikácií, napr. cievnej mozgovej príhody
| Trieda EHRA | Popis |
|---|---|
| EHRA I | Bez príznakov |
| EHRA II | Mierne príznaky: bežné denné činnosti bez obmedzenia |
| EHRA III | Závažné príznaky: obmedzenie bežných denných činností |
| EHRA IV | Príznaky vedúce k invalidite: bežné denné činnosti nemožno vykonávať |
12-zvodové EKG vyšetrenie sa štandardne používa na potvrdenie diagnózy FiP (1,13). Na základe EKG môže lekár odlíšiť FiP od iných foriem arytmie (13). EKG tiež umožňuje odhaliť známky štrukturálneho srdcového ochorenia (napr. infarkt myokardu, hypertrofiu ľavej komory, ramienkové blokády, syndróm komorovej preexcitácie, kardiomyopatiu alebo ischémiu) (13).
FiP je definovaná na základe nasledujúcich EKG parametrov: (13)
- Povrchové EKG vykazuje „absolútne“ nepravidelné intervaly RR (t.j. žiadny opakujúci sa vzor).
- Na povrchovom EKG nie sú prítomné žiadne zreteľné P vlny (aj keď na niektorých zvodoch je možné pozorovať zjavne pravidelnú predsieňovú aktivitu).
- Ak je možné na EKG rozpoznať predsieňovú aktiváciu, tak interval medzi nimi je krátky a premenlivý. Typicky tento interval neprekračuje 200 ms, čo vedie k frekvencii predsiení > 5 tepov za sekundu alebo > 300 tepov za minútu (13). Prevodný systém AV uzla však neprenesie všetky tieto vzruchy do komôr (20). Výsledkom je, že komorová frekvencia (alebo pulz) je nižšia (ako predsieňová), ale zvyčajne aj tak vyššia ako normálne.
- Ak arytmia spĺňa tieto kritériá a trvá dostatočne dlho, aby bola zaznamenaná na 12-zvodovom EKG (alebo na najmenej 30 sekundovom zázname srdcového rytmu, tzv. rhythm strip), je treba ju považovať za FiP (13).
Nasledujúci obrázok znázorňuje záznam EKG s normálnym, tzv. sínusovým rytmom a záznam EKG FiP. Všimnite si, že na zázname FiP nie je prítomná vlna P; P vlny môžu úplne chýbať alebo môžu byť nahradené vlnami f v jednom alebo viacerých zvodoch (17,37). Aj keď QRS komplexy sú na zázname FiP prítomné, ich časovanie je nepravidelné (17).
Normálny EKG záznam a záznam pri FiP (17):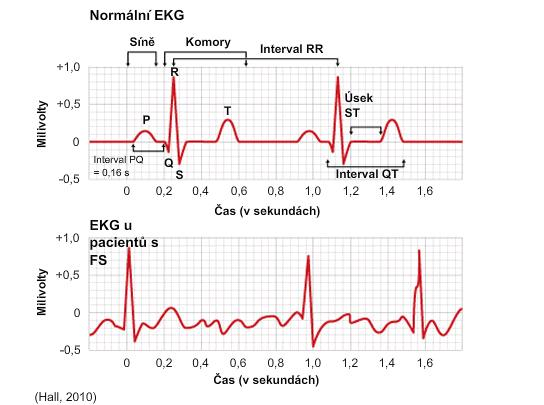
Štandardné 12-zvodové EKG zaznamenáva elektrickú aktivitu srdca len počas krátkej doby. Vzhľadom k prerušovanému charakteru paroxyzmálnej FiP môže byť jej diagnostikovanie obzvlášť náročné. Pomocou 12-zvodového EKG je možné diagnózu paroxyzmálnej FiP potvrdiť len ak sa vyskytne počas záznamu. V opačnom prípade môžeme pri diagnostike a vyhodnotení paroxyzmálnej FiP využiť ambulantné monitorovanie EKG počas 24 hodín alebo 7 dní pomocou Holterovho monitorovania EKG, záznamníkmi EKG aktivovanými prítomnosťou príznakov alebo inými zariadeniami (38,13).
Holterov monitor je prenosné zariadenie, ktoré pacient nosí pri sebe a ktoré zaznamenáva jeho EKG alebo krvný tlak. Záznamníky epizód môže spúšťať buď pacient keď sa objavia príznaky, alebo sa môže spúšťať automaticky, keď EKG zachytí arytmiu (38). Niektoré záznamníky epizód sú implantovateľné a umožňujú dlhodobý monitoring FiP. Implantovateľné slučkové záznamníky sú miniatúrne zariadenia, ktoré sa minimálne invazívnym spôsobom subkutánne implantujú na prednú stranu hrudníka.
Počas 3 rokov sú schopné kontinuálne monitorovať činnosť srdca a v prípade výskytu arytmie ju zaznamenať, a to buď automaticky alebo pacientom ak je arytmia symptomatická. Samotný prístroj je súčasťou systému, ktorý umožňuje bezdrôtový prenos dát priamo ošetrujúcemu lekárovi. Spoločne s implantovateľným kardiostimulátorom môžu tieto prístroje dlhodobo a nepretržite zaznamenávať údaje, čo je dôležité hlavne u pacientov s paroxyzmálnou asymptomatickou formou FiP.
EKG vyšetrenie zohráva tiež dôležitú úlohu pri diagnostikovaní ale aj následnom sledovaní pacienta. 12-zvodové EKG sa používa pri všetkých kontrolných návštevách k vyhodnoteniu srdcovej frekvencie a rytmu, k vyhodnoteniu progresie ochorenia a ku kontrole účinkov súvisiacich s liečbou. Záznamníky epizód a Holterove monitory je možné použiť aj v prípade podozrenia na FiP alebo príznakov súvisiacich s liečbou (13).
Transtorakálna echokardiografia (TTE) je štandardným postupom pri echokardiografickom (ultrazvukovom) vyšetrení srdca. K tomuto vyšetreniu sa používa sonda, ktorá vysiela ultrazvukové vlny, ktoré sa odrážajú späť od štruktúr vnútri tela. Doba, za ktorú sa pulz odrazí, zodpovedá vzdialenosti objektu od sondy; sila odrazu informuje o jeho zložení. Sonda sníma v „tvare vejára“: pohybom po tele zachytáva prierezy srdca v rôznych rovinách (20).
Roviny ultrazvukového vyšetrenia pri TTE: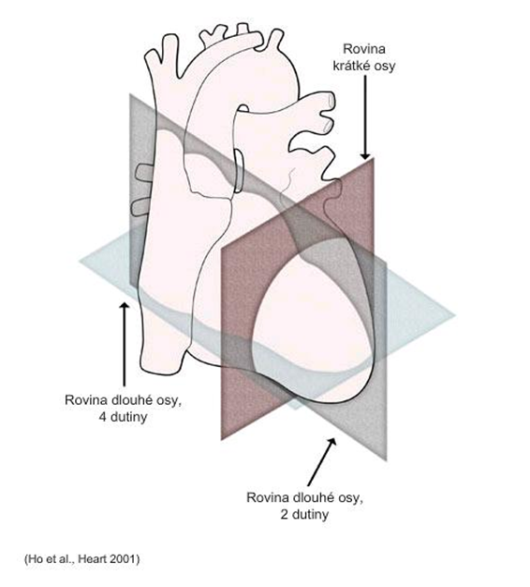 Pri Dopplerovej TTE je možné zaznamenávať tiež smer a rýchlosť pohybu krvi. TTE je možné využiť na: (1)
Pri Dopplerovej TTE je možné zaznamenávať tiež smer a rýchlosť pohybu krvi. TTE je možné využiť na: (1)
- zistenie prítomnosti ochorenia srdcových chlopní,
- stanovenie veľkosti predsiení a komôr,
- hodnotenie veľkosti ľavej komory a jej funkcie (systolickej a diastolickej),
- stanovenie maximálneho tlaku v pravej komore (na diagnostikovanie pľúcnej hypertenzie),
- zistenie hypertrofie ľavej komory,
- detekciu trombu v ľavej predsieni (LP) (pozri kapitola FiP a tromboembolická choroba), hoci citlivosť TTE je pre tieto účely nízka,
- detekciu ochorení perikardu.
Aktuálne smernice ESC z roku 2010 však rutinné používanie TTE u všetkých pacientov neodporúčajú. Smernice ESC uznávajú, že TTE môže poskytnúť užitočné informácie, ale je treba poznamenať, že nemôže vylúčiť prítomnosť trombu v ULP (uško ľavej predsiene) (13).
Pri transezofageálnej echokardiografii (TEE) sa sonda zavádza do pažeráka (ezofagu) (39). Sonda sa tak dostane do tesnej blízkosti srdca, čo umožňuje získať vysoko kvalitné snímky (1). TEE je metóda s vysokou citlivosťou a špecificitou na detekciu kardiogénnej embolizácie pre tromby v ľavej predsieni a v ušku ľavej predsiene (1) TEE sa síce neodporúča ako súčasť rutinného vstupného vyšetrenia, (1,13) môže však byť použitá na vylúčenie intrakardiálnych trombov pred kardioverziou u tých pacientov, u ktorých FiP trvá viac ako 48 hodín alebo jej trvanie nie je známe (13 ).
Pri stanovení diagnózy FiP je za istých okolností potrebné realizovať ďalšie, nižšie uvedené vyšetrenia: (1, 13)
- 6-minútorvý test chôdzou: pri pochybnostiach o adekvátnosti kontroly frekvencie.
- Záťažový test: na overenie, či sa srdcová frekvencia počas záťaže príliš nezvyšuje (pri vysokých frekvenciách je činnosť srdca neefektívna a u pacientov môže dôjsť k rozvoju ischémie myokardu), alebo u vybraných pacientov na vylúčenie ischémie pred zahájením liečby antiarytmikami triedy IC.
- Elektrofyziologická štúdia: (invazívne metódy) k vyhodnoteniu funkcie sínusového uzla, k objasneniu mechanizmu tachykardie so širokým QRS komplexom, na identifikovanie predisponujúcej arytmie ako flutter predsiení alebo paroxyzmálna supraventrikulárna tachykardia alebo na vyhľadávanie miest pre kuratívnu abláciu alebo blokovanie/úpravu AV vedenia.
- RTG snímka hrudníka: na vyhodnotenie parenchýmu pľúc alebo pľúcnej vaskulatúry, ak klinické nálezy vykazujú abnormality.
Liečba FiP a prevencia jej závažných komplikácií
Vzhľadom na riziko vzniku CMP nezáleží na tom, či pacient trpí paroxyzmálnou alebo permanentnou FiP, pretože riziko CMP je u oboch typov FiP podobné (2x vyššie než v zdravej populácii). Preto je manažment pacientov s obidvoma formami FiP zameraný súbežne na redukciu symptómov arytmie a zároveň na prevenciu závažných komplikácií FiP.
Medzi hlavné komplikácie FiP patria: úmrtie, cievna mozgová príhoda, hospitalizácia a zhoršená kvalita života. Prevencia závažných komplikacií súvisiacich s FiP spočíva:
a) v kontrole srdcovej frekvencie a rytmu (tzv. antiarytmická liečba),
b) v antitrombotickej liečbe (liečba na prevenciu tromboembolizmu – vzniku cievnej mozgovej príhody a systémovej embolizácie),
c) v adekvátnej liečbe sprievodných srdcových ochorení.
Kontrola srdcovej fekcencie a rytmu
Jednotlivé stratégie kontroly tepovej frekvencie a srdcového rytmu u pacientov s FiP sa od seba líšia svojimi cieľmi. Cieľom terapie upravujúcej srdcový rytmus je znovu navodiť alebo udržať sínusový rytmus. Pri terapii upravujúcej tepovú frekvenciu síce FiP pretrváva, ale frekvencia komôr je spomalená (kontrolovaná). Pokiaľ úvodná voľba medzi kontrolou tepovej frekvencie a kontrolou srdcového rytmu nevedie k pozitívnym výsledkom, je možné vyskúšať alternatívny postup.
Stratégie kontroly tepovej frekvencie a srdcového rytmu zahŕňajú:
- farmakoterapiu,
- elektrickú kardioverziu,
- rádiofrekvenčnú katetrizačnú abláciu,
- chirurgickú liečbu,
- kardiostimulátory.
Farmakoterapia zabezpečí úpravu srdcového rytmu podaním liečiv – tzv. antiarytmík. Medzi lieky používané na kontrolu tepovej frekvencie a srdcového rytmu podľa Vaughan-Williamsovej klasifikácie patria:
- Antiarytmiká na kontrolu srdcového rytmu:
Trieda I: blokátory sodíkových kanálov
Trieda III: blokátory draslíkových kanálov. - Antiarytmiká na kontrolu tepovej frekvencie:
Trieda II: beta-blokátory
Trieda III:
Trieda IV: iné ako dihydropyridínové blokátory kalciových kanálov
Digitálisové glykozidy
V klinickej praxi je termín antiarytmiká vyhradený zvyčajne (ale nie vždy) pre liečivá triedy I a triedy III, pretože beta-blokátory (trieda II) a blokátory kalciových kanálov (trieda IV) nedokážu konvertovať FiP a len vzácne sú schopné udržať sínusový rytmus po kardioverzii.
Kardioverzia, t.j. obnova sínusového rytmu, môže byť indikovaná u pacientov so závažnými príznakmi, spojenými s hypotenziou, ischémiou myokardu alebo srdcovým zlyhaním. Kardioverziu je možné dosiahnuť aplikáciou elektrického výboja (elektrická kardioverzia) alebo jednorazovým intravenóznym podaním úvodnej dávky antiarytmika (farmakologická kardioverzia).
Elektrická kardioverzia je postup uplatňovaný hlavne na akútnu ale aj na elektívnu kontrolu srdcového rytmu, pri ktorej sa rýchla srdcová frekvencia prevádza pomocou elektrického výboja na sínusový rytmus.
Elektrická kardioverzia pomocou defibrilátora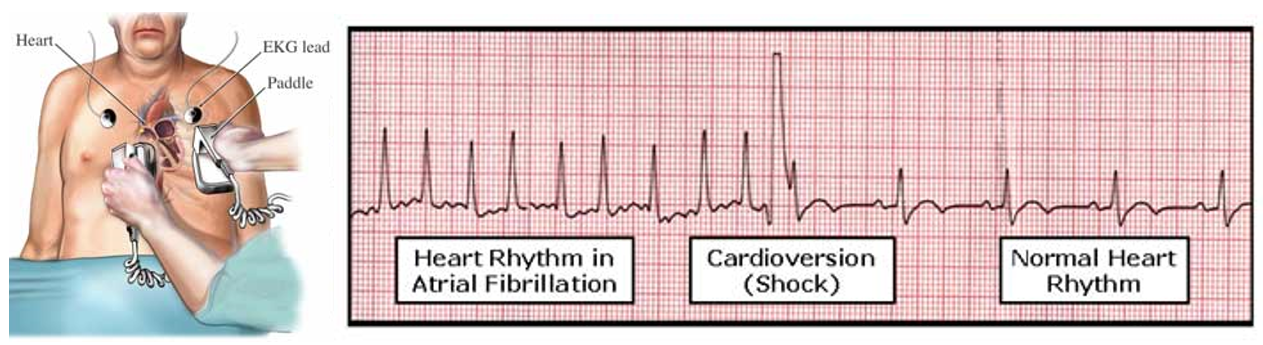
Elektrická kardioverzia je vysoko účinná (90%), ale vyžaduje sedáciu pri vedomí pacienta alebo jeho celkovú anestéziu. Kardioverzia antiarytmikami nevyžaduje sedáciu pri vedomí ani anestézu, je však menej účinná ako elektrická kardioverzia. Sínusový rytmus dosiahne 47-84% pacientov s FiP trvajúcou < 24 hodín a 15-30% pacientov s FiP trvajúcou > 48 hodín.
Kardioverzia neodstráni samotnú príčinu FiP a je teda možné predpokladať recidívu FiP, predovšetkým u pacientov, ktorí antiarytmiká neužívajú ďalej. Len u približne 30-50% pacientov, ktorí podstúpili elektrickú kardioverziu je po 12 mesiacoch od zákroku stále zachovaný sínusový rytmus. Kardioverzia je u pacientov s FiP spojená s rizikom vzniku cievnej mozgovej príhody a periférneho tromboembolizmu . Pred prevedením elektívnej kardioverzie u pacientov s FiP, ktorá trvá > 48 hodín alebo doba jej trvania nie je známa, je nevyhnutné zahájiť efektívnu antikoagulačnú liečbu (optimálne 3 týždne pred a s pokračovaním 4 týždne po zákroku).
Dlhodobá kontrola tepovej frekvencie je indikovaná u väčšiny pacientov s FiP. Predstavuje primárnu stratégiu u pacientov s permanentnou FiP, u ktorých nie je možné po kardioverzii udržať sínusový rytmus alebo bolo rozhodnuté kardioverziu už nerealizovať. Medzi farmakoterapeutiká používané na dlhodobú kontrolu tepovej frekvencie patria beta-blokátory, iné ako dihydropyridínové blokátory kalciových kanálov a srdcové glykozidy.
Cieľová frekvencia komôr a voľba liečebného režimu sa u jednotlivých pacientov líšia v závislosti na rôznych faktoroch (napr. životný štýl a sprievodné ochorenia). U niektorých pacientov môže byť indikovaná kombinácia liekov upravujúcich tepovú frekvenciu.
Ak u pacientov príznaky FiP pretrvávajú alebo antiarytmiká nie sú tolerované alebo sú neúčinné, je možné zvážiť nefarmakologickú terapiu, ako sú rádiofrekvenčná ablácia alebo kryoablácia ľavej predsiene, tzv. otvorená MAZE operácia alebo ablácia atrioventrikulárneho uzla a trvalá kardiostimulácia. Abláciu je možné realizovať s použitím rádiofrekvenčnej energie, kryoterapie (zmrazenie a opätovné zahriatie tkaniva), fokusovaného ultrazvuku vysokej intenzity alebo laserovej energie.
Pre prístup k arytmogénnemu substrátu, “ohnisku” arytmie, sa najčastejšie využíva katetrizácia srdca, teda ide o elektívny invazívny zákrok, ktorý vyžaduje dočasné prerušenie antitrombotickej liečby. Priaznivé výsledky ablácie atrioventrikulárneho uzla možno očakávať najčastejšie u symptomatických pacientov alebo u pacientov s tachykardiou navodenou kardiomyopatiou spôsobenou rýchlou frekvenciou komôr, ktorú nie je možné kontrolovať iným spôsobom.
Nevýhodami tejto liečby sú trvalá potreba antikoagulácie, strata atrioventrikulárnej synchronizácie, doživotná potreba kardiostimulátora a tiež všetky riziká spojené s katetrizáciou srdca. Po ablácii je nevyhnutné použiť premosťovaciu liečbu nízkomolekulárnym heparínom alebo intravenóznym nefrakcionovaným heparínom, a to až do obnovenia perorálnej systémovej antikoagulácie. Premosťovacia liečba by mala trvať najmenej 3 mesiace, aj keď v niektorých centrách pri ablácii antikoagulačnú terapiu neprerušujú vôbec. Podávanie antiarytmík nijako neznižuje potrebu antitrombotickej liečby a je možné, že v nej bude potrebné pokračovať aj po katetrizačnej ablácii.
Ablácia: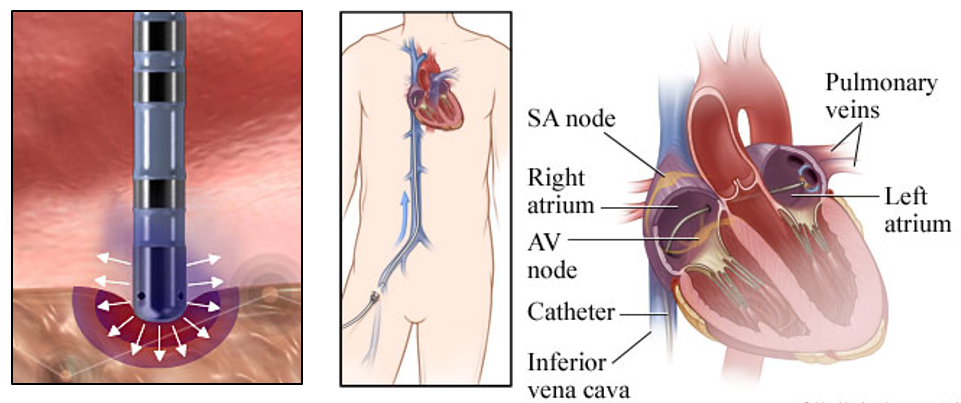
Pokiaľ katetrizačná ablácia nie je účinná, je možné použiť chirurgickú abláciu. Medzi chirurgické techniky patrí MAZE operácia (známa tiež ako Cox-Maze operácia), ktorá sa robí pri chirurgických operáciách srdca, napr. u pacientov s kardiopulmonálnym bypasom. Touto technikou, ktorá spočíva v početných incíziách v pravej aj ľavej predsieni, je možné docieliť prerušenie re-entry okruhov zodpovedných za FiP.
Súčasťou operácie je uzatvorenie uška ľavej predsiene. Teda dalšou možnosťou chirurgickej liečby FiP je zavedenia špeciálnej drôtennej zátky, ktorá okluduje (uzatvára) uško ľavej predsiene a znižuje riziko vzniku trombu. Toto zariadenie sa na miesto zavádza pomocou katétra bez potreby chirurgickej intervencie.
Odporúčania pre antitrombotickú liečbu pri FiP
Výber antitrombotickej terapie je podmienený rizikom vzniku cievnej mozgovej príhody. Pred iniciovaním antitrombotickej liečby na prevenciu budúcej alebo opakovanej cievnej mozgovej príhody je potrebné stanoviť individuálne riziko CMP u pacienta s FiP. Hlavnými rizikovými faktormi vzniku CMP pri FiP sú prekonaná cievna mozgová príhoda, TIA (tranzitórny ischemický atak), tromboembolická choroba a pokročilý vek, ktoré sú hodnotené 2 bodmi.
Rizikovými faktormi, ktoré sú hodnotené 1 bodom, sú „klinicky relevantné menej významné“ rizikové faktory: srdcové zlyhanie (predovšetkým stredne závažná až závažná systolická dysfunkcia ľavej komory), hypertenzia, diabetes mellitus, ženské pohlavie, vek 65–74 rokov, cievne ochorenie (t.j. infarkt myokardu, komplikovaný aterómový plát aorty a ochorenie periférnych tepien) (Tabuľka 3)13 Pre účely stanovenia individuálneho rizika vzniku cievnej mozgovej príhody u pacientov s FiP bolo vypracovaných viacero skórovacích systémov pre stratifikáciu rizika, z ktorých podľa posledných odporúčaní ESC z roku 2012, sa v súčasnej praxi používa skórovací systém CHA2DS2-VASc.
Prístup založený na rizikových faktoroch ohodnotených podľa skórovacieho systému (CHA2DS2-VASc):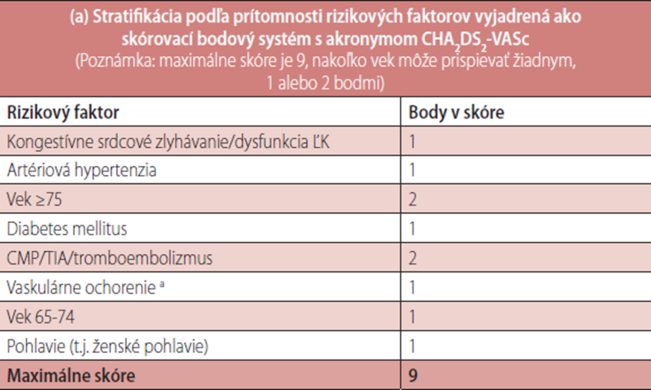
Pred nastavením pacienta na antitrombotickú liečbu je potrebné stanoviť aj riziko krvácania, na čo sa používa tzv. HAS-BLED skórovací systém (Tabuľka 4). Úlohou HAS-BLED je indentifikovať chorých, ktorí si na antitrombotickej liečbe vyžadujú zvýšené klinické sledovanie (HAS-BLED ≥ 3) z dôvodu zvýšeného rizika krvácania a so snahou minimalizovať všetky ovplyvniteľné faktory (nemá slúžiť na zdôvodnenie kontraindikácií antitrombotickej liečby).
HAS-BLED skórovací systém: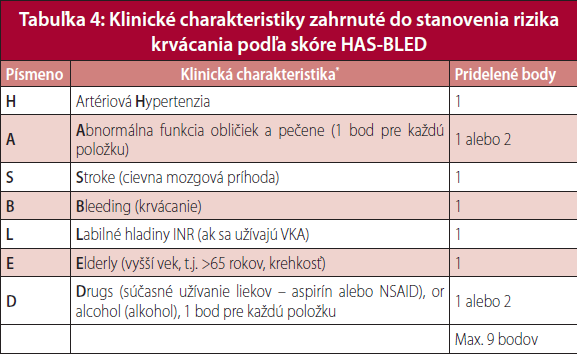
V odporúčaniach ESC (European Society of Cardiology) pre preventívnu liečbu cievnej mozgovej príhody a systémovej embólie u pacientov s FiP z roku 2010, sa uvádza, že u pacientov s FiP by sa mala uprednostniť antikoagulačná alebo žiadna liečba pred podávaním antiagregačnej liečby, v závislosti na ich CHA2DS2-VASc riziku vzniku cievnej mozgovej príhody.
Odporúčania ESC pre prevenciu CMP/SE pri FiP: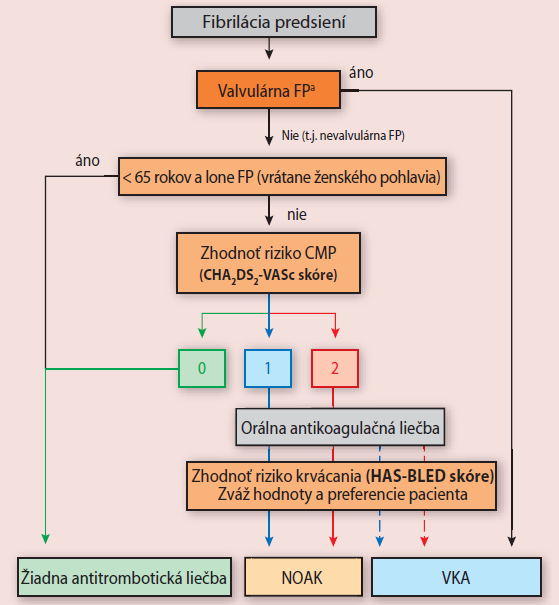
NOAK – Perorálne antikoagulanciá okrem antagonsitov vitamínu K
VKA – antagonisty vitamínu K
- Pacienti bez rizikových faktorov vzniku cievnej mozgovej príhody by radšej nemali dostávať žiadnu antitrombotickú terapiu než aby boli liečení antiagregačnou liečbou.
- U väčšiny pacientov s 1 klinicky relevantným menej významným rizikovým faktorom sa má zvážiť skôr antikoagulačná terapia než podávanie antiagregačnej liečby.
- Pacienti s 1 významným alebo ≥ 2 klinicky relevantnými menej významnými rizikovými faktormi by mali užívať antikoagulačnú terapiu – NOAK alebo VKA.
- U pacientov s nízkym rizikom krvácania, ktorí odmietnu liečbu VKA alebo je u nich táto liečba kontraindikovaná, by sa mala zvážiť kombinovaná terapia antiagreganciami.
Aktualizácia týchto ESC odporúčaní z roku 2012 sa zameriava na dopady čerstvých klinických údajov o nových perorálnych antikoagulanciách (NOAK):
- Všetky doterajšie klinické štúdie s NOAK preukázali minimálne ich non-inferioritu v porovnaní s antagonistami vitamínu K, vrátane porovnateľného alebo nižšieho výskytu závažných krvácaní a vždy s preukázanou redukciou intrakraniálneho krvácania.
- Pokiaľ je teda liečba s NOAK odporúčaná, je treba u väčšiny pacientov s FiP zvážiť podávanie buď priameho inhibítora trombínu alebo perorálneho inhibítora faktora Xa namiesto VKA s úpravou dávkovania (INR 2,0 – 3,0), v súlade s platnými preskripčnými a indikačnými obmedzeniami.
- Neexistuje dostatok údajov pre odporúčanie jedného NOAK na úkor iného, napriek tomu môžu pri rozhodovaní o voľbe lieku hrať dôležitú úlohu niektoré charakteristiky pacienta, compliance a znášanlivosť, ako aj výška nákladov na liečbu.
Antagonisty vitamínu K sú chemicky nazývané aj kumaríny alebo kumarínové deriváty. Prerušujú cyklus vitamínu K tým, že inhibujú produkt vitamín K epoxid reduktázy a vitamín K reduktázy, čo zabraňuje aktivácii faktorov II, VII, IX a X koagulačnej kaskády. Antagonisty vitamínu K sa používajú v klinickej praxi už vyše 60 rokov. Profil ich účinnosti a bezpečnosti v prevencii vzniku cievnej mozgovej príhody u pacientov s FiP bol stanovený v niekoľkých klinických štúdiách a metaanalýzach.
Tie potvrdili, že antagonisty vitamínu K oproti placebu redukujú relatívne ročné riziko cievnej mozgovej príhody o 68%. Liečba antagonistami vitamínu K je spojená s rizikom krvácavých komplikácií pričom tou najzávažnejšou a najobávanejšou komplikáciou je intrakraniálne krvácanie. Ďalšími komplikáciami pri terapii antagonistami vitamínu K sú potreba častého sledovania za účelom udržania hodnoty INR v terapeutickom rozsahu (2,0 – 3,0); genetické faktory a interakcie mnohých liekov a stravy ovplyvňujúce u mnohých pacientov veľkosť potrebnej dávky warfarínu; obzvlášť problematické je dávkovanie u starších pacientov.
Hodnoty INR u mnohých pacientov užívajúcich warfarín nie sú udržiavané v cieľovom terapeutickom rozsahu. Títo pacienti sú vystavení riziku tromboembolických príhod, pokiaľ je INR pod terapeutickým rozsahom a riziku krvácania, pokiaľ je INR nad terapeutickým rozsahom. Je to v dôsledku úzkeho terapeutického okna a širokej individuálnej variability ich účinku (vzťah medzi dávkou a odpoveďou je nepredvídateľný).
AntiagreganciáÚčinok antiagregancií spočíva v tom, že zabraňujú zhlukovaniu krvných doštičiek. Klinické štúdie pri FiP a metaanalýza údajov z týchto štúdií preukázala, že antiagreganciá sú menej účinné ako antagonisty vitamin K v prevencii CMP/SE. Platí to pri použití antiagregancií prvej generácie, druhej generácie ako aj dvojkombinácie antiagregancií. Napriek tomu ale táto kombinácia zvyšuje výskyt krvácaní a spája sa s potenciálnou gastorintestinálnou toxicitou.
Nové perorálne antikoagulanciá (NOAK) v prevencii CMP pri FiPPraktické nevýhody spojené s používaním antagonistov vitamínu K viedli k vývoju novšej generácie liekov, ktoré sú minimálne rovnako účinné a bezpečné ale nevyžadujú laboratórne monitorovanie a úpravu dávok. Nazývajú sa nové perorálne antikoagulanciá (NOAK) alebo aj tzv. priame perorálne antikoagulanciá. Keďže faktor Xa aj trombín sú súčasťou ako vnútornej, tak aj vonkajšej koagulačnej kaskády, majú ich inhibítory výhodu oproti liekom, ktoré pôsobia len na jednej strane kaskády alebo na viacerých miestach kaskády.
Miesta účinku priamych inhibítorov faktora Xa a priamych inhibítorov trombínu: (98)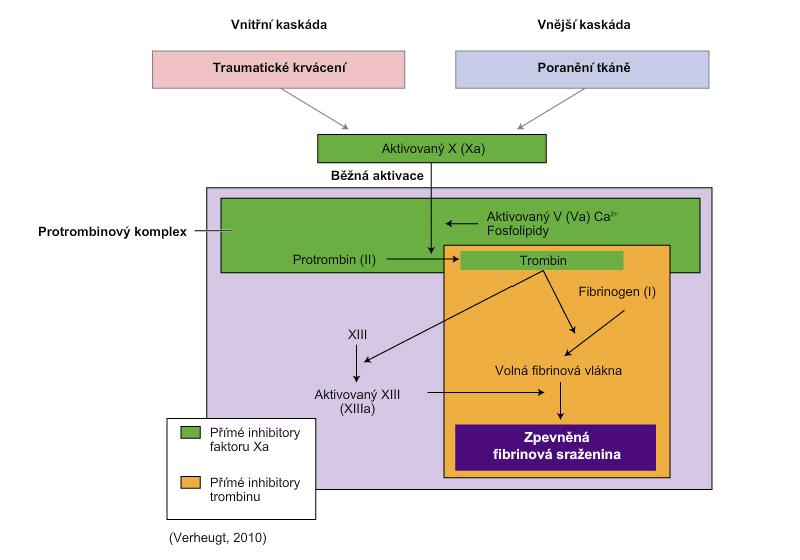
Existujú dve triedy nových (priamych) perorálnych antikoagulancií:
- Priame inhibítory trombínu (gatrany): účinkujú priamym naviazaním na voľný trombín alebo trombín viazaný na fibrín a zabraňujú tak účinkom trombínu a oslabujú tvorbu trombínu. Vedú k predvídateľnému antikoagulačnému účinku, pretože sa neviažu na plazmatické bielkoviny.
- Priame inhibítory faktora Xa (xabany): účinkujú priamym naviazaním na voľný faktor Xa a aj na faktor Xa viazaný v protrombínázovom komplexe, čím inhibujú tvorbu trombínu, pričom pre svoju aktivitu nevyžadujú interakciu s antitrombínom ako napr. nízkomolekulové heparíny. Tieto lieky na rozdiel od priamich inhibítorov trombínu neovplyvňujú reziduálnu aktivitu už vytvoreného trombínu.
V klinických štúdiách a metaanalýzach pacientov s nevalvulárnou FiP preukázali NOAK oproti antagonistom vitamínu K minimálne porovnateľnú alebo lepšiu účinnosť (redukcia CMP/SE) a bezpečnosť (redukcia závažných krvácaní), vrátane významnej redukcii intrakraniálnych krvácaní. Ich ďalšie výhody oproti antagonistom vitamínu K sú predvídateľná farmakokinetika a farmakodynamika, dobrá perorálna biologická dostupnosť, rýchly nástup účinku, fixná dávka bez nutnosti laboratórneho monitorovania a nízke riziko interakcií s inými liekmi bez ovplyvnenia stravou alebo diétou (potraviny s obsahom vitamínu K).
Medzi limitácie NOAK patrí napr. ich momentálne schválenie len pre vymedzené indikácie a skupiny pacientov (nie je ich možné napríklad použiť u pacientov s náhradami chlopní) ako aj menšie praktické skúsenosti (hoci rýchlo sa rozširoujúce) v konkrétnych situáciách a preto aj absencia jasných odporúčaní pre niektoré špecifické situácie (napr. Kombinácia s liekmi na prevenciu rekurencie akútnych koronárnych syndrómov). Cena liečby NOAK je v súčasnosti stale tiež vyššia ako v prípade použitia antagonistov vitamin K.
Zdroje:
1) Curtis AB, January CT, Ellenbogen KA, Lowe JE, Estes NA 3rd, Page RL, Ezekowitz MD, Slotwiner DJ, Jackman WM, Stevenson WG, y Tracy CM. ACCF/ AHA/HRS Focused Update on the Management of Patients With Atrial Fibrillation (Updating the 2006 Guideline): A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2011; 123:104-123.2) Lloyd-Jones DM, Wang TJ, Leip EP, et al. Lifetime risk for development of atrial fibrillation. Circulation 2004; 110(9):1042-1046.
3) Heeringa J, van der Kuip DA, Hofman A, Kors JA, van Herpen G, Stricker BH, Stijnen T, Lip GY, Witteman JC. Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam study. Eur Heart J 2006; 27(8):949-53.
4) Lloyd-Jones D, Adams RJ, Brown TM, et al; for the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics 2010 update: a report from the American Heart Association. Circulation 2010; 121(7):e46-e215.
5) Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: The Framingham Study. Stroke 1991; 22(8):983-988.
6) Lamassa M, Di Carlo A, Pracucci G, et al. Characteristics, outcome, and care of stroke associated with atrial fibrillation in Europe: data from a multicenter multinational hospital-based registry (The European Community Stroke Project). Stroke 2001; 32(2):392-398.
7) Dulli DA, Stanko H, Levine RL. Atrial fibrillation is associated with severe acute ischemic stroke. Neuroepidemiology 2003; 22(2):118-123.
8) Penado S, Cano M, Acha O, Herna#ndez JL, Riancho JA. Atrial fibrillation as a risk factor for stroke recurrence. Am J Med 2003; 114(3):206-10.
9) Marini C, De Santis F, Sacco S, et al. Contribution of atrial fibrillation to incidence and outcome of ischemic stroke. Stroke 2005; 36(6):1115-1119.
10) Kammersgaard LP, Olsen TS. Cardiovascular risk factors and 5-year mortality in the Copenhagen Stroke Study. Cerebrovasc Dis 2006; 21(3):187-93.
11) Carter AM, Catto AJ, Mansfield MW, Bamford JM, Grant PJ. Predictive variables for mortality after acute ischemic stroke. Stroke 2007; 38(6):1873-80.
12) Hannon N, Sheehan O, Kelly L, Marnane M, Merwick A, Moore A, Kyne L, Duggan J, Moroney J, McCormack PM, Daly L, Fitz-Simon N, Harris D, Horgan G, Williams EB, Furie KL, Kelly PJ. Stroke associated with atrial fibrillation-incidence and early outcomes in the north Dublin population stroke study. Cerebrovasc Dis 2010; 29(1):43-9.
13) Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Guidelines for the management of atrial fibrillation. Eur Heart J 2010; 31(19):2369-429.
14) Ringborg A, Nieuwlaat R, Lindgren P, Jo#nsson B, Fidan D, Maggioni AP, Lopez-Sendon J, Stepinska J, Cokkinos DV, Crijns HJ. Costs of atrial fibrillation in five European countries: results from the Euro Heart Survey on atrial fibrillation. Europace 2008; 10(4):403-11.
15) Al-Saady NM, Obel OA, Camm AJ. Left atrial appendage: structure, function, and role in thromboembolism. Heart 1999; 82(5):547-555.
16) Mitchell BL. Cardiac disorders: arrhythmias and conduction disorders. Merck Manual for Healthcare Professionals (online). Available at: http://www.merckmanuals.com/professional/sec07/ch075/ch075a.html#sec07-ch075-ch075a-1003 (accessed: November 2010).
17) Hall JE. Guyton and Hall Textbook of Medical Physiology. 12th ed. Philadelphia, PA, Saunders Elsevier, 2011.
18) Kourliouros A, Savelieva I, Kiotsekoglou A, Jahangiri M, Camm J. Current concepts in the pathogenesis of atrial fibrillation. Am Heart J 2009; 157(2):243-252.
19) Veenhuyzen GD, Simpson CS, Abdollah H. Atrial fibrillation. CMAJ 2004; 171(7):755-760.
20) Bono RO, Douglas LM, Douglas PZ, Lippy P. Braunwald’s Heart Disease: A Textbook of Cardiovascular Medicine. 6th ed. Philadelphia, PA, WB Saunders, 2012.
21) Eds. Libby P, Bonow RO, Mann DL, Zipes DP, Braunwald E. Braunwald’s Heart Disease: A Textbook of Cardiovascular Medicine. 8th ed. Philadelphia, PA, Saunders Elsevier, 2008.
22) Shea MJ. Electrocardiography. Merck Manual of Diagnosis and Therapy. 2009. Available at: http://www.merckmanuals.com/professional/sec07/ch070/ ch070e.html?qt=ecg&alt=sh (accessed: April 2011).
23) Crandall MA, Bradley DJ, Packer DL, Asirvatham SJ. Contemporary management of atrial fibrillation: update on anticoagulation and invasive management strategies. Mayo Clin Proc 2009; 84:643-662.
24) Viswanathan MN, Page RL. Pharmacological therapy for atrial fibrillation: current options and new agents. Expert Opin Investig Drugs 2009; 18:417-431.
25) Guyton AC, Hall JE. Textbook of Medical Physiology. 11th ed. Philadelphia, Pennsylvania, Elsevier Inc, 2006.
26) Nieuwlaat R, Capucci A, Camm AJ, Olsson SB, Andresen D, Davies DW, Cobbe S, Breithardt G, Le Heuzey JY, Prins MH, Lévy S, Crijns HJ; European Heart Survey Investigators. Atrial fibrillation management: a prospective survey in ESC member countries: the Euro Heart Survey on Atrial Fibrillation. Eur Heart J 2005; 26(22):2422-34.
27) Nabauer M, Gerth A, Limbourg T, Schneider S, Oeff M, Kirchhof P, Goette A, Lewalter T, Ravens U, Meinertz T, Breithardt G, Steinbeck G. The Registry of the German Competence NETwork on Atrial Fibrillation: patient characteristics and initial management. Europace 2009; 11(4):423-34.
28) Khairy P, Nattel S. New insights into the mechanisms and management of atrial fibrillation. CMAJ 2002; 167(9):1012-1020.
29) Aviles RJ, Martin DO, Apperson-Hansen C, et al. Inflammation as a risk factor for atrial fibrillation. Circulation 2003; 108(24):3006-3010.
30) Kirchhof P, Auricchio A, Bax J, Crijns H, Camm J, Diener HC, Goette A, Hindricks G, Hohnloser S, Kappenberger L, Kuck KH, Lip GY, Olsson B, Meinertz T, Priori S, Ravens U, Steinbeck G, Svernhage E, Tijssen J, Vincent A, Breithardt G. Outcome parameters for trials in atrial fibrillation: recommendations from a consensus conference organized by the German Atrial Fibrillation Competence NETwork and the European Heart Rhythm Association. Europace 2010; 9(11):1006-23.
31) Friberg L, Hammar N, Rosenqvist M. Stroke in paroxysmal atrial fibrillation: report from the Stockholm Cohort of Atrial Fibrillation. Eur Heart J 2010; 31(8):967-75. 32) Flaker GC, Belew K, Beckman K et al. Asymptomatic atrial fibrillation: demographic features and prognostic information from the Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) study. Am Heart J 149(4):675-663.
33) Jahangir A, Lee V, Friedman PA, et al. Long-term progression and outcomes with aging in patients with lone atrial fibrillation: a 30-year follow-up study. Circulation 2007; 115(24):3050-3056.
34) Rho RW, Page RL. Asymptomatic atrial fibrillation. Prog Cardiovasc Dis 2005; 48(2):79-87.
35) Savelieva I, Camm AJ. Clinical relevance of silent atrial fibrillation: prevalence, prognosis, quality of life, and management. J Interven Cardiac Electrophys 2000; 4:369-382.
36) Padanilam BJ, Prystowsky EN. Atrial fibrillation: goals of therapy and management strategies to achieve the goals. Med Clin North Am 2008; 92:217-235.
37) Hoppe BL, Kahn AM, Feld GK, Hassankhani A, Narayan SM. Separating atrial flutter from atrial fibrillation with apparent electrocardiographic organization using dominant and narrow F-wave spectra. J Am Coll Cardiol 2005; 46:2079-2087.
38) Dewar RI, Lip GYH; for the Guidelines Development Group for the NICE Clinical Guideline for the Management of Atrial Fibrillation. Identification, diagnosis and assessment of atrial fibrillation. Heart 2007; 93(1):25-28.
39) Flachskampf FA, Decoodt P, Fraser AG, Daniel WG, Roelandt JRTC for the Subgroup on Transoesophageal Echocardiography and Valvular Heart Disease, on behalf of the Working Group on Echocardiography of the European Society of Cardiology. GUIDELINES FROM THE WORKING GROUP. Recommendations for Performing Transoesophageal Echocardiography. Eur J Echocardiography 2001; 2:8-21.
40) Go AS, Hylek EM, Phillips KA, et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Rish Factors In Atrial Fibrillation (ATRIA) Study. JAMA 2001; 285(18):2370-2375.
41) DeWilde S, Carey IM, Emmas C, Richards N, Cook DG. Trends in the prevalence of diagnosed atrial fibrillation, its treatment with anticoagulation and predictors of such treatment in UK primary care. Heart 2006; 92(8):1064-70.
42) Murphy NF, Simpson CR, Jhund PS, Stewart S, Kirkpatrick M, Chalmers J, MacIntyre K, McMurray JJ. A national survey of the prevalence, incidence, primary care burden and treatment of atrial fibrillation in Scotland. Heart 2007; 93(5):606-12.
43) Schmutz M, Beer-Borst S, Meiltz A, Urban P, Gaspoz JM, Costanza MC, Morabia A, Zimmermann M. Low prevalence of atrial fibrillation in asymptomatic adults in Geneva, Switzerland. Europace 2010; 12(4):475-81.
44) Smith JG, Platonov PG, Hedblad B, Engström G, Melander O. Atrial fibrillation in the Malmö Diet and Cancer study: a study of occurrence, risk factors and diagnostic validity. Eur J Epidemiol 2010; 25(2):95-102.
45) Friberg J, Scharling H, Gadsbøll N, Jensen GB. Sex-Specific Increase in the Prevalence of Atrial Fibrillation. (The Copenhagen City Heart Study). Am J Cardiol 2003; 92:1419-1423.
46) Benjamin EJ, Levy D, Vaziri SM, D’Agostino RB, Belander AJ, Wolf PA; for the Framingham Heart Study. Independent risk factors for atrial fibrillation in a population-based cohort. The Framingham Heart Study. JAMA 1994; 271(11):840-844.
47) Miyasaka Y, Barnes ME, Gersh BJ, et al. Secular trends in incidence of atrial fibrillation in Olmsted County, Minnesota, 1980 to 2000, and implications on the projections for the future prevalence. Circulation 2006; 114(2):119-125.
48) Rietbrock S, Heeley E, Plumb J, van Staa T. Chronic atrial fibrillation: Incidence, prevalence, and prediction of stroke using the Congestive heart failure, Hypertension, Age >75, Diabetes mellitus, and prior Stroke or transient ischemic attack (CHADS2) risk stratification scheme. Am Heart J 2008; 156(1):57-64.
49) Kannel WB, Benjamin EJ. Current perceptions of the epidemiology of atrial fibrillation. Cardiol Clin 2009; 27(1):13-24.
50) Alonso A, Agarwal SK, Soliman EZ, Ambrose M, Chamberlain AM, Prineas RJ, Folsom AR. Incidence of atrial fibrillation in whites and African-Americans: the Atherosclerosis Risk in Communities (ARIC) study. Am Heart J 2009; 158(1):111-7.
51) Tedrow UB, Conen D, Ridker PM, Cook NR, Koplan BA, Manson JE, Buring JE, Albert CM. The long- and short-term impact of elevated body mass index on the risk of new atrial fibrillation the WHS (women’s health study). J Am Coll Cardiol 2010; 55(21):2319-27.
52) Reinecke H, Brand E, Mesters R, Schäbitz WR, Fisher M, Pavenstädt H, Breithardt G. Dilemmas in the management of atrial fibrillation in chronic kidney disease. J Am Soc Nephrol 2009; 20:705-711.
53) Soliman EZ, Prineas RJ, Go AS, Xie D, Lash JP, Rahman M, Ojo A, Teal VL, Jensvold NG, Robinson NL, Dries DL, Bazzano L, Mohler ER, Wright JT, Feldman HI. Chronic kidney disease and prevalent atrial fibrillation: the Chronic Renal Insufficiency Cohort (CRIC). Am Heart J 2010; 159(69):1102-1107.
54) Ananthapanyasut W, Napan S, Rudolph EH, Harindhanavudhi T, Ayash H, Guglielmi KE, Lerma EV. Prevalence of atrial fibrillation and its predictors in nondialysis patients with chronic kidney disease. Clin J Am Soc Nephrol 2010; 5:173-181.
55) Aronow WS. Acute and chronic management of atrial fibrillation in patients with late-stage CKD. Am J Kidney Dis 2009; 53(4):701-710.
56) McManus DD, Corteville DCM, Shlipak MG, Whooley MA, Ix JH. Relation of kidney function and albuminuria with atrial fibrillation (from the Heart and Soul Study). Am J Cardiol 2009; 104(11):1551-1555.
57) Deo R, Katz R, Kestenbaum B, Fried L, Sarnak MJ, Psaty BM, Siscovick DS, Shlipak MG. Impaired kidney function and atrial fibrillation in elderly subjects. J Card Fail 2010; 16(1):55-60.
58) Vaziri SM, Larson MG, Benjamin EJ, Levy D. Echocardiographic predictors of nonrheumatic atrial fibrillation. The Framingham Heart Study. Circulation 1994; 89(2):724-30.
59) Mukamal KJ, Tolstrup JS, Friberg J, Jensen G, Grønbaek M. Alcohol consumption and risk of atrial fibrillation in men and women: the Copenhagen City Heart Study. Circulation 2005; 112(12):1736-42.
60) Conen D, Tedrow UB, Cook NR, Moorthy MV, Buring JE, Albert CM. Alcohol consumption and risk of incident atrial fibrillation in women. JAMA 2008; 300(21):2489-96. 61) MMWR Morb Mortal 2007. Prevalence of chronic kidney disease and associated risk factors: United States, 1999-2004. MMWR Morb Mortal. Wkly Rep 2007; 56:161-165. 62) Goetz CG. Textbook of Clinical Neurology. 2nd ed. Philadelphia, PA, Saunders Elsevier, 2003.
63) Donnan GA, Fisher M, Macleod M, Davis SM. Stroke. Lancet 2008; 371(9625):1612-1623.
64) Kirchhof P. How can we prevent a stroke crisis? Working group report: Stroke prevention in patients with atrial fibrillation. 2009; ISBN 978-1-903539-09-5.
65) Adams HP Jr, Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL, Marsh EE. 3rd. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke 1993; 24(1):35-41.
66) Furie KL, Kasner SE, Adams RJ, Albers GW, Bush RL, Fagan SC, Halperin JL, Johnston SC, Katzan I, Kernan WN, Mitchell PH, Ovbiagele B, Palesch YY, Sacco RL, Schwamm LH, Wassertheil-Smoller S, Turan TN, Wentworth D; on behalf of the American Heart Association Stroke Council, Council on Cardiovascular Nursing, Council on Clinical Cardiology, and Interdisciplinary Council on Quality of Care and Outcomes Research. Guidelines for the Prevention of Stroke in Patients With Stroke or Transient Ischemic Attack. A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke [Epub ahead of print] 2010. 67) Kolominsky-Rabas PL, Weber M, Gefeller O, Neundoerfer B, Heuschmann PU. Epidemiology of ischemic stroke subtypes according to TOAST Criteria: Incidence, recurrence, and long-term survival in ischemic stroke subtypes: A population-based study. Stroke 2001; 32:2735-2740.
68) Easton JD, Saver JL, Albers GW, et al; for the American Heart Association, American Stroke Association Stroke Council, Council on Cardiovascular Surgery and Anesthesia, Council on Cardiovascular Radiology and Intervention, Council on Cardiovascular Nursing, Interdisciplinary Council on Peripheral Vascular Disease. Definition and evaluation of transient ischemic attack: a scientific statement for healthcare professionals from the American Heart Association/American Stroke Association Stroke Council; Council on Cardiovascular Surgery and Anesthesia; Council on Cardiovascular Radiology and Intervention; Council on Cardiovascular Nursing; and the Interdisciplinary Council on Peripheral Vascular Disease. The American Academy of Neurology affirms the value of this statement as an educational tool for neurologists. Stroke 2009; 40(6):2276-2293.
69) Goldman L, Ausiello D. CECIL Textbook of Medicine. Saunders Elsevier. 2004.
70) Dirnagl U, Iadecola C, Moskowitz MA. Pathobiology of ischaemic stroke: an integrated view. Trends Neurosci 1999; 22(9):391-397.
71) Menke J, Lu#thje L, Kastrup A, Larsen J. Thromboembolism in atrial fibrillation. Am J Cardiol 2010; 105(4):502-510.
72) Thygesen SK, Frost L, Eagle KA, Johnsen SP. Atrial fibrillation in patients with ischemic stroke: A population-based study. Clin Epidemiol 2009; 1:55-65.
73) European Stroke Organization (ESO) Executive Committee and the ESO Writing Committee. Guidelines for Management of Ischaemic Stroke and Transient Ischaemic Attack 2008 (January 2009 update).
74) Albers GW, Amarenco P, Easton JD, Sacco RL, Teal P. Antithrombotic and Thrombolytic Therapy for Ischemic Stroke. Chest 133:630-669.
75) National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke. N Engl J Med 1995; 333(24):1581-7.
76) Actilyse. Summary of product characteristics. Boehringer Ingelheim Limited. 2009.
77) Petersen S, Peto V, Rayner M, Leal J, Luengo-Fernandez R, Gray A. European cardiovascular disease statistics. London, BHF, 2005.
78) Watson T, Shantsila E, Lip GYH. Mechanisms of thrombogenesis in atrial fibrillation: Virchow’s triad revisited. Lancet 2009; 373(9658):155-166.
79) Lip GYH, Lim HS. Atrial fibrillation and stroke prevention. Lancet Neurol 2007; 6(11):981-993.
80) Ito T, Suwa M, Nakamura T, Miyazaki S, Kobashi A, Kitaura Y. Quantification of left atrial appendage spontaneous echo contrast in patients with chronic nonvalvular atrial fibrillation. J Cardio 2001; 37(6):325-333.
81) Weir NU. An update on cardioembolic stroke. Postgrad Med J 2008; 84(989):133-142.
82) Hart RG, Benavente O, McBride R, Pearce LA. Antithrombotic therapy to prevent stroke in patients with atrial fibrillation: a meta-analysis. Ann Intern Med 1999; 131:492-501.
83) Hart RG, Pearce LA, McBride R, Rothbart RM, Asinger RW; for the Stroke Prevention in Atrial Fibrillation (SPAF) Investigators. Factors associated with ischemic stroke during aspirin therapy in atrial fibrillation: analysis of 2012 participants in the SPAF I-III clinical trials. Stroke 1999; 30:1223-1229.
84) Hart RG, Pearce LA, Aguilar MI, et al. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007; 146(12):857-867.
85) Petersen P, Boysen G, Godtfredsen J, Andersen ED, Andersen B. Placebo-controlled, randomised trial of warfarin and aspirin for prevention of thromboembolic complications in chronic atrial fibrillation. The Copenhagen AFASAK study. Lancet 1989; 1(8631):175-179.
86) SPAF Investigators 1991. Prevention in Atrial Fibrillation Study. Final results. Circulation 1991; 84(2):527-539.
87) BAATAF Investigators 1990. The effect of low-dose warfarin on the risk of stroke in patients with nonrheumatic atrial fibrillation. The Boston Area Anticoagulation Trial for Atrial Fibrillation Investigators. N Engl J Med 1990; 323(22):1501-1511.
88) Connolly SJ, Laupacis A, Gent M, Roberts RS, Cairns JA, Joyner C. for the CAFA Study Coinvestigators. Canadian Atrial Fibrillation Anticoagulation (CAFA) Study. J Am Coll Cardiol 1991; 18(2):349-355.
89) Ezekowitz MD, Bridgers SL, James KE, Carliner NH, Colling CL, Gornick CC, Krause-Steinrauf H, Kurtzke JF, Nazarian SM, Radford MJ. Warfarin in the prevention of stroke associated with nonrheumatic atrial fibrillation. Veterans Affairs Stroke Prevention in Nonrheumatic Atrial Fibrillation Investigators. N Engl J Med 1992; 327(20):1406-1412.
90) Internet Stroke Center. Modified Rankin scale (MRS). Available at: http:// www.strokecenter.org (accessed: September 2010).
91) Stroke Risk in Atrial Fibrillation Working Group. Independent predictors of stroke in patients with atrial fibrillation: a systematic review. Neurology 2007; 69(6):546-554.
92) Atrial Fibrillation Investigators. Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Arch Intern Med 1994; 154(19):1449-1457. 93) Singer DE, Albers GW, Dalen JE, et al. Antithrombotic therapy in atrial fibrillation: American College of Chest Physicians evidence-based clinical practice guidelines (8th ed). Chest 2008; 133(suppl 6):546S-592S.
94) Gage BF, Waterman AD, Shannon W, Boechler M, Rich MW, Radford MJ. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA 2001; 285(22):2864-2870.
95) Lip GYH, Nieuwlaat R, Pisters R, Lane DA, Crijns HJGM. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the Euro Heart Survey on Atrial Fibrillation. Chest 2010; 137(2):263-272.
96) Lip GY, Frison L, Halperin JL, Lane DA. Identifying Patients at High Risk for Stroke Despite Anticoagulation. A Comparison of Contemporary Stroke Risk Stratification Schemes in an Anticoagulated Atrial Fibrillation Cohort. Stroke 2010; 41 DOI: 10.1161/STROKEAHA.110.590257.
97) Wang TJ, Massaro JM, Levy D, et al. A risk score for predicting stroke or death in individuals with new-onset atrial fibrillation in the community. The Framingham Heart Study. JAMA 2003; 290(8):1049-1056.
