Leukémia
Vďaka inováciám v cielenej liečbe rakovinových ochorení krvi možno čoskoro odzvoní chemoterapii. Nové lieky útočia iba na rakovinové bunky a likvidujú ich zvonka aj zvnútra.

Ako vzniká chronická lymfocytová leukémia
Chronická lymfocytová leukémia (CLL) je typom rakoviny, pri ktorej dochádza k nekontrolovanému bujneniu a hromadeniu nefunkčných bielych krviniek (konkrétne B lymfocytov) v kostnej dreni. Premnožené B lymfocyty postupne potláčajú zdravú tvorbu krvi v kostnej dreni. To vedie k nedostatku zdravých bielych a červených krviniek a krvných doštičiek, ktoré sú potrebné pre zdravý život. Postupne dochádza k nahromadeniu nádorových buniek aj v krvi, v lymfatických uzlinách, slezine a pečeni. CLL je najčastejšou leukémiou dospelých v západných krajinách, preto vývoj v jej liečbe a diagnostike príkladne ukazuje, ako sa za niekoľko desaťročí zmenili možnosti liečby tohto typu ochorenia.
Nesmrteľné bunky
B lymfocyt je bunka, ktorej prirodzeným osudom je zomrieť. Buď ju nemá čo živiť a zaniká (apoptóza), alebo naplní svoju funkciu – zneškodní cudzorodú látku (antigén) v tele. Ak dôjde k jej stretu s antigénom, začína sa deliť, dozrieva a špecializuje sa.
Naopak, geneticky poškodená malígna bunka bujnie a nezomiera. Bunka má sama potrebu množiť sa, aj keď k tomu nemá vonkajší podnet, ako to je pri zdravých bunkách.
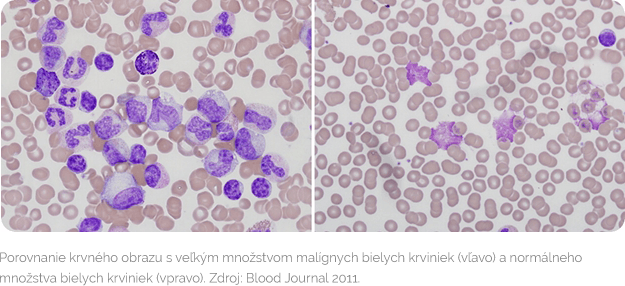
Páchateľ je zatiaľ neznámy
Zatiaľ nepoznáme jednoznačný faktor, ktorý by bol príčinou vzniku CLL. Nejde o dedičné ochorenie, aj keď je riziko vzniku vyššie v rodinách, kde sa už leukémia vyskytla. Analýza genetiky pacientov s CLL ukázala, že u časti z nich sú prítomné určité genetické zmeny. Ide napríklad o zmenu štruktúry chromozómov alebo ich počtu. S rozvojom, šírením a prežívaním malígnych B buniek pri CLL je spojených niekoľko faktorov:
- aktivácia B bunkového receptora (BCR)
- interakcia s prostredím
- chronická stimulácia antigénmi
- poškodenie génov
Bunky CLL závisia nielen na vnútorných cestách, ale sú tiež podporované vonkajšími signálmi, ktoré poskytuje mikroprostredie tkaniva. BCR (B bunkový receptor) je kľúčový pre normálny vývoj B buniek a je aj súčasťou vývoja väčšiny B bunkových malignít. BCR reguluje viacero bunkových procesov vrátane šírenia, delenia, apoptózy (programovej smrti bunky) a migrácie bunky. To všetko sú procesy dôležité pre fungovanie a prežívanie zdravých aj malígnych B buniek.
Prečo sa nás CLL týka aj na Slovensku
CLL je najčastejšou leukémiou dospelých v západných krajinách – tvorí štvrtinu až tretinu zo všetkých leukémií dospelých. Ochorenie sa takmer nevyskytuje vo východnej Ázii, napríklad v Japonsku. V Európe pribudnú ročne asi tri prípady CLL na 100 000 obyvateľov a väčšina pacientov má v čase diagnózy viac ako 65 rokov. Muži sú postihnutí dvakrát častejšie ako ženy a majú zvyčajne agresívnejší priebeh ochorenia.
Emília Flochová - lekárka: Ako pacienti reagujú na diagnózu a čo sa v ich živote zmení?
Koľko stojí liečba
Podľa odhadov nákladov z Nemecka stojí ročne liečba jedného pacienta s CLL takmer 5 000 eur z jeho súkromných zdrojov a takmer 8 000 eur sú náklady pre štát. Najnákladnejšie sú hospitalizácie a nákup liekov. V porovnaní s ostatnými rozšírenejšími chorobami (napríklad cukrovka) sú celkové náklady na liečbu všetkých pacientov s CLL výrazne nižšie. Liečba CLL prepočítaná na jedného pacienta je ale asi dvakrát taká nákladná.
Ako prebieha ochorenie CLL
Diagnóza po rokoch bez príznakov
CLL prebieha roky bez príznakov. Asi pri polovici pacientov spočiatku nič nenasvedčuje, že sú chorí. Títo pacienti sú často diagnostikovaní iba náhodne v rámci preventívnych prehliadok. Pri podozrení je dôležité overiť, či pacient má skutočne CLL a nie podobné ochorenie postihujúce lymfatický systém. Najjednoduchšie vyšetrenie je laboratórne vyšetrenie vzorky krvi. V krvnom obraze býva zvýšený počet B lymfocytov (bielych krviniek) jedného typu, čo sa označuje ako absolútna lymfocytóza. Diagnóza CLL vyžaduje prítomnosť aspoň 5 x 10*9 B lymfocytov na liter periférnej krvi (krv, ktorá obieha v cievach). Leukemické bunky v krvnom nátere sú zvyčajne malé vyspelé lymfocyty s úzkym okrajom cytoplazmy a plným jadrom, v ktorom sa nedá rozoznať jadierko, a ktoré má čiastočné zhromaždený chromatín (vláknitá substancia v bunkovom jadre). Pre stanovenie diagnózy CLL nie je nevyhnutné vykonávať vyšetrenie kostnej drene ani histologické vyšetrenie uzlín. Vyšetrenie kostnej drene sa robí hlavne pre objasnenie príčiny anémie (málo červených krviniek) alebo trombocytopénie (málo krvných doštičiek).
CLL sa okrem zvýšeného počtu lymfocytov môže prejaviť aj klinicky:

zníženým počtom krvných doštičiek, častejším výskytom infekcií

zväčšením sleziny / pečene

slabosťou, zvýšenou teplotou, nočným potením

zväčšením lymfatických uzlín
Tri štádiá ochorenia
Na určenie štádia ochorenia sa v prípade CLL štandardne používajú dva klasifikačné systémy: (modifikovaný) Rai (používa sa skôr v USA) a Binet (v Európe). V oboch systémoch je pacient na základe výsledkov vyšetrení a prognózy zaradený do jednej z troch rizikových skupín (nízke, stredné a vysoké). Oba systémy sa spoliehajú na fyzikálne vyšetrenia a štandardné laboratórne testy a nevyžadujú ultrazvuk, počítačovú tomografiu (CT) ani magnetickú rezonanciu.

Poznanie štádia leukémie pomáha odhadnúť, ako sa bude leukémia správať a naplánovať podľa toho liečbu. CLL má veľmi variabilný priebeh a celkové prežívanie sa pohybuje od niekoľkých mesiacov až po niekoľko rokov. Medián prežívania pacientov s CLL je približne 10 rokov.
Noví pacienti čakajú
Novo diagnostikovaní pacienti, ktorí spadajú do raných štádií ochorenia, spravidla nie sú liečení. Prebieha u nich pozorovanie (watch and wait), pokiaľ sa neukáže, že sa choroba ďalej rozvíja. Viac ako polovica pacientov nepotrebuje liečbu až desať rokov od zistenia choroby. Vedľajšie účinky skorej liečby sú pre organizmus veľkou záťažou a liečba neprináša také zlepšenia, aby bola nasadená už v začiatkoch ochorenia. Aktívna liečba pomáha pacientom v rozvinutejších štádiách ochorenia. Prudký prechod z postupne sa vyvíjajúceho ochorenia do agresívnej formy sa nazýva Richterova transformácia – podľa lekára, ktorý ju ako prvý popísal. Tento proces postihne asi desatinu pacientov s CLL a spravidla pri ňom vzniká difúzny lymfóm z B lymfocytov.
Ako lepšie určiť rizikové prípady
Nevýhodou „klasických“ klasifikačných systémov je, že nedokážu v ranom štádiu identifikovať tých chorých, ktorí môžu mať nepriaznivý klinický priebeh ochorenia. Taktiež nezohľadňujú mechanizmus vzniku niektorých komplikácií a nie sú schopné predpovedať odpoveď na liečbu. Vývoj preto prebieha aj v oblasti prognostiky a hľadajú sa prognostické faktory, ktoré by dokázali čo najpresnejšie určiť individuálne riziko a vedeli by identifikovať potenciálne agresívne formy CLL už v skorom štádiu. Dnes sa ako najperspektívnejšie zdajú byť nové skupiny prognostických faktorov skúmajúcich poškodenia a mutácie génov.
Prognóza pacienta
Každý lekár musí sledovať vývoj v liečbe CLL, keďže nové postupy a lieky prichádzajú pravidelne. V porovnaní so situáciou spred desiatich rokov sa dnes pacienti dožívajú vyššieho veku a môžu aj s chorobou viesť kvalitnejší život. Dôležité je, aby mali možnosť dostať sa k tej liečbe, ktorá ukazuje najsľubnejšie výsledky.
Emília Flochová - lekárka: Ako sa zmenila diagnostika pacientov?
Liečba CLL
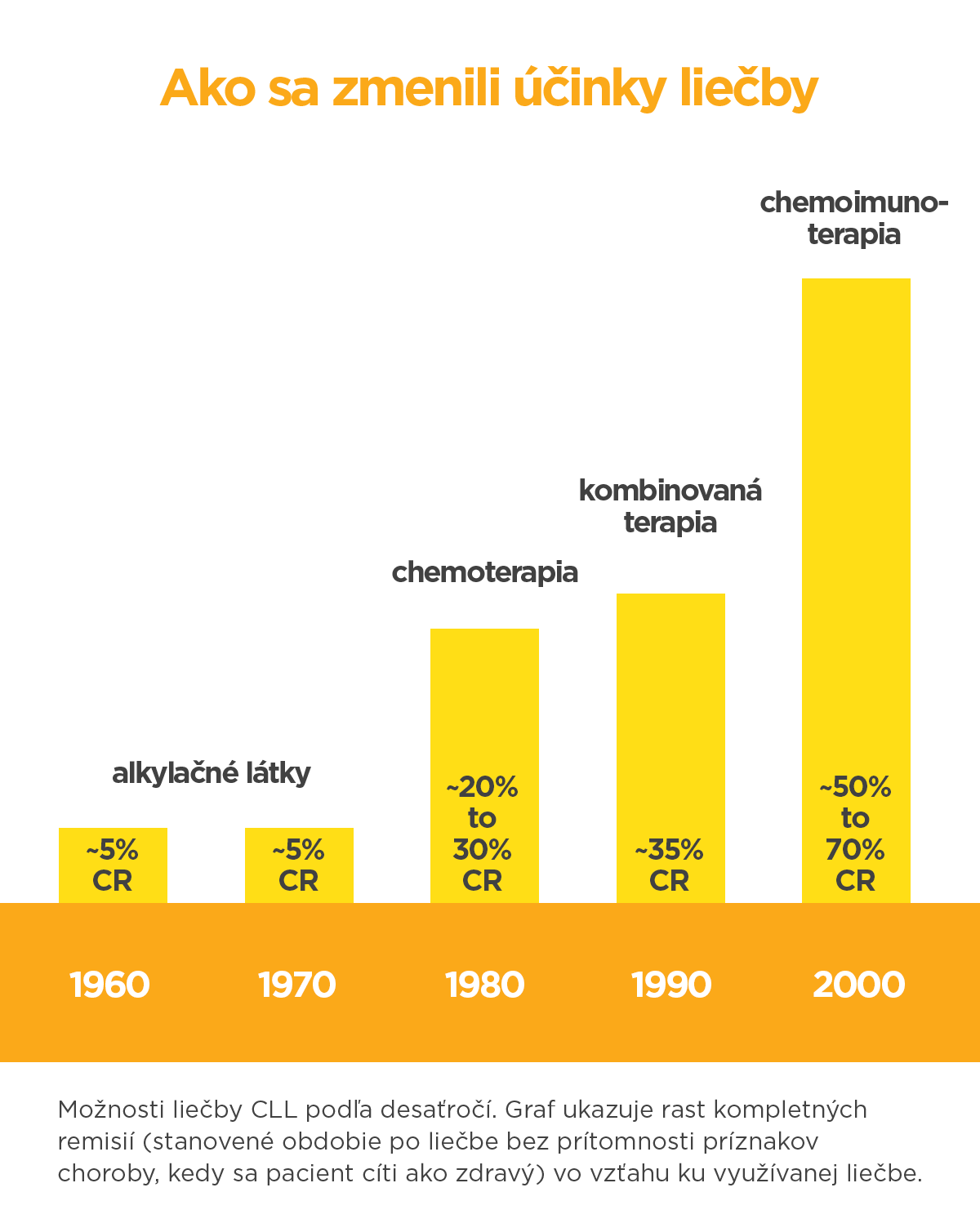
O spôsobe liečby pacientov s CLL rozhoduje niekoľko faktorov: štádium ochorenia, prítomnosť symptómov, aktivita ochorenia, stav a priania pacienta. U väčšiny pacientov sa zatiaľ nedá hovoriť o možnosti úplného vyliečenia, skôr o predlžovaní období bez choroby a obmedzovaní vedľajších účinkov liečby.
Napriek tomu došlo za niekoľko desaťročí k výraznému zlepšeniu prognózy pacientov s CLL a to najmä vďaka prelomom vo vývoji nových liekov. Kým „stará“ liečba sa vo veľkej miere spoliehala na plošné pôsobenie chemoterapie, nová sa snaží cieliť svoj účinok na procesy v chorých bunkách a v ich okolí.
Najnovší vývoj v CLL ukazuje práve týmto smerom – ku cielenej liečbe, kde sa liečivo zameriava na konkrétny prvok na chorej bunke a jej následné „odstavenie“ z krvného obehu. Pozitívnom okrem samotnej liečby a zvyšovania období bez príznakov choroby sú slabšie vedľajšie účinky v porovnaní s chemoterapiou.
Emília Flochová - lekárka: Ako sa zmenila liečba CLL a kvalita života pacientov?
Transplantácie
Alogénna transplantácia (od inej osoby) krvotvorných kmeňových buniek je dnes jedinou možnosťou úplného vyliečenia CLL, pričom môže vyliečiť asi 40 % pacientov. Podmienkou úspešnej transplantácie je dosiahnutie dobrej čiastočnej alebo úplnej remisie (potlačenie ochorenia). Táto transplantácia má však vysokú toxicitu a úmrtnosť, je vhodná pre chorých v nižšom veku, ktorí majú vysokorizikovú CLL rezistentnú na štandardnú liečbu. Pre väčšinu pacientov neprichádza transplantácia do úvahy.
Alkylačné látky
Monoterapia, liečba využívajúca jediný liek, s alkylačnými látkami (látky, ktoré reagujú s centrami bunkových štruktúr) dlho slúžila ako prvá línia terapie pre pacientov s CLL, pre mnohých tento účel napĺňa dodnes. Výhodou je menšia toxicita, nižšie náklady a pohodlnosť používania. Hlavnou nevýhodou je veľmi nízka až neexistujúca kompletná remisia (stav, kedy liečba odstráni všetky príznaky choroby) a niektoré vedľajšie účinky z dlhodobého užívania.
Chemoterapia
Kombinácia purínových analógov a alkylačných látok sa v liečbe CLL považuje za zlatý štandard a znamenala veľký posun v liečbe tohto ochorenia. Viaceré štúdie ukázali pri tejto kombinácii predĺženie prežívania bez choroby, ako aj mediánu dĺžky obdobia bez liečby. Chemoterapeutické lieky plošne útočia na bunky, ktoré sa rýchlo delia. Tým dokážu zasiahnuť rakovinové bunky, ale aj tie zdravé. To spôsobuje vedľajšie efekty, ktorých následky sa môžu zmierňovať ďalšími liekmi.
Monoklonové protilátky

Monoklonové protilátky sú človekom vytvorené proteíny imunitného systému (protilátky), ktoré majú za cieľ napojiť sa na určený „terč“ – v tomto prípade sú to proteíny na povrchu rakovinových buniek. Tieto lieky pomáhajú imunitnému systému pacienta reagovať a ničiť rakovinové bunky.
Monoklonové protilátky sa od konvenčnej chemoterapie odlišujú mechanizmom pôsobenia, aj vedľajšími účinkami. Monoklonová protilátka anti-CD20 sa dnes štandardne používa v liečbe non-Hodgkinových lymfómov.
Chemoimunoterapia
Kombinácia chemoterapie s monoklonovou protilátkou je základom liečby pri mladších pacientoch, ktorí sú fyzicky v dobrom stave. Štúdie ukazujú, že toto spojenie prináša pacientom zlepšenie vo všetkých hlavných parametroch – dobu bez príznakov choroby, prežívanie bez progresie, aj celkové prežitie. Nežiaduce účinky obmedzujú podávanie tejto kombinácie iba na pacientov, ktorí sú fit.
Cielená terapia – od plošného pôsobenia k špeciálnemu nasadeniu
Liečba CLL prešla v uplynulých rokoch veľkým vývojom. Celkové prežívanie pacientov sa zlepšilo najmä vďaka novým prognostickým faktorom a aktívnej chemoimunoterapii. Napriek tomu ostáva CLL zatiaľ nevyliečiteľnou chorobou (okrem využitia riskantnej transplantácie), kde majú najlepšie vyhliadky nanešťastie iba tí pacienti, u ktorých nedochádza k zhoršovaniu.
To, čo by podľa doterajších výsledkov mohlo priniesť prelom, sú lieky zameriavajúce sa na cesty, ktoré sú súčasťou procesu vývoja, šírenia a prežívania B buniek.
Vo vývoji je dnes rastúci počet nových liekov cieliacich práve na zmeny vnútri buniek, ktoré spôsobujú, že bunka sa stane rakovinovou. Spoločným menovateľom týchto nových liekov je, že pôsobia na relatívne špecifickú signalizačnú abnormalitu alebo dokážu presmerovať imunitný systém proti CLL bunkám.
Prvky cielené na signalizačné receptory B buniek
Nové cielené liečivá (ako napr. inhibítory kináz) blokujú signály, ktoré stimulujú malígne bunky k rastu a nekontrolovanému deleniu. Jedná sa napr. o blokádu Brutonovej tyrozín kinázy (BTK) alebo kinázy s označením PI3K, ktoré sú kľúčovými molekulami signálnej dráhy B-receptora. Táto dráha je dôležitá pre prežitie malígnej B bunky.
Výsledky klinických štúdií s liečivami cielenými na rôzne prenášače BCR signalizácie sú dnes veľmi povzbudivé. Dôležitosť tejto signálnej kaskády je hlavným dôvodom rastúceho záujmu o možnosť cielenia na kľúčových “hráčov” na ceste.
Na rozdiel od prvej generácie cielenej liečby v podobe niektorých monoklonových protilátok, tieto látky ovplyvňujú procesy vnútri bunky, konkrétne blokovaním B-receptorovej dráhy a následne ďalších dejov, ktoré by ináč viedli k bujneniu malígnych B lymfocytov.
Inhibítory BCR zatiaľ vykazujú nízku toxicitu a vysokú účinnosť prie liečbe recidivujúcej CLL, ako aj pacientov, ktorí na inú liečbu v prvej línii nereagovali. Ďalšou skupinou pacientov, ktorým táto liečba môže pomôcť, sú vysoko rizikoví pacienti, pri ktorých je vylúčená chemoimunoterapia.
BCL2 inhibítory
Proteíny v rodine BCL2 (B-bunka CLL/lymfóm 2) sú kľúčové pri regulácii procesu programovej smrti buniek (apoptóza). Skupina BCL2 pozostáva z proteínov, ktoré povzbudzujú (zdravú) programovú smrť buniek (pro-apoptické) a takých, ktoré posilňujú prežívanie buniek.
Presun rovnováhy k pro-prežívacím proteínom je zaužívaný mechanizmus, ktorým sa leukemické bunky bránia odumretiu. Nové liečivá v tejto kategórii sa snažia korigovať tento stav.
Prvé testy ukázali pozitívne výsledky pre niektoré z týchto liečiv, hoci ako silný vedľajší účinok sa pri nich javí najmä veľký pokles počtu krvných doštičiek. Liečivo bolo preto prestavané tak, zabraňovalo rastu tumorov závislých na BCL2 a zároveň, aby šetrilo krvné doštičky. Výsledky ukazujú, že toto bude v budúcnosti jedna z ciest pre liečbu CLL.
Emília Flochová - lekárka: Zaobídeme sa pri liečbe niekedy bez chemoterapie?
Ako môže vyzerať liečba o pár rokov
Všetky nové postupy pri CLL sa zameriavajú na relatívne špecifické signálne proteíny CLL buniek a na ich mikroprostredie. To dáva nový pohľad na charakter liečby. Celková toxicita nových látok je mierna a tieto látky neznižujú aktivitu kostnej drene.
Podľa najnovších poznatkov sa zdá, že CLL môže byť spôsobená celým radom udalostí na úrovni génov. Nové účinné látky sa tak ukazujú ako cesta, ktorá by pri liečbe CLL mohla priniesť optimálne výsledky. Výzvou zostáva nastavenie najlepšej kombinácie liekov a ich následnosť tak, aby bolo ochorenie pod dlhodobou kontrolou a aby sa zvyšovala kvalita života pacienta.
Cieľom “starej” liečby bývalo najprv zredukovať výskyt ochorenia, teda nasadením plošnej chemoterapie odstrániť čo najviac rakovinových buniek. Meradlom úspešnosti takejto liečby je to, koľko chorých buniek sa nachádza v krvi (tzv. MRD – minimal residual disease). Po agresívnej liečbe by malo nasledovať obdobie bez liečby.
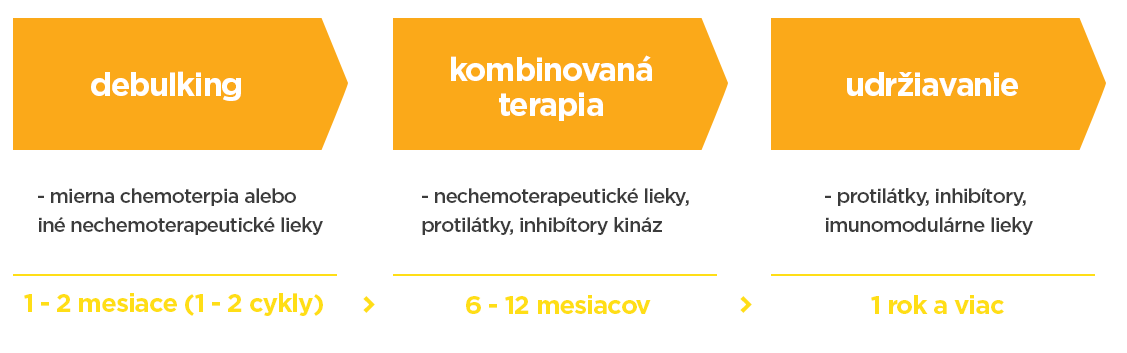
S novými látkami, ktoré máme k dispozícii dnes, by sa prístup k liečbe mohol postaviť na troch krokoch v závislosti na počiatočnom rozšírení tumoru a na reakciách na jednotlivé postupy:
S istotou môžem povedať, že do desiatich rokov a možno aj piatich rokov bude CLL oveľa menším klinickým problémom. Nové látky môžu úplne zmeniť klinickú cestu tejto choroby.
V prípade zvýšeného počtu bielych krviniek alebo veľkých lymfatických uzlín je prvým voliteľným krokom debulking, teda krátka liečba zameraná na zníženie rozsahu ochorenia. Znamená to jeden alebo dva cykly miernej chemoterapie prípadne iných nechemoterapeutických liekov. Cieľom je rýchle očistenie periférnej krvi od CLL buniek, čo by sa malo dosiahnuť za jeden až dva mesiace.
V druhom kroku prichádza kombinovaná cielená terapia. Sú podávané nechemoterapeutické lieky, najskôr protilátky, po niekoľkých dňoch inhibítory kináz alebo BCL2 inhibítory (alebo oboje). Táto fáza môže trvať niekoľko mesiacov až dovtedy, kým sa zlepšuje remisia alebo nie je dosiahnutá úplná remisia.
Cieľom tretej fázy je udržanie veľmi dobrej remisie. To by sa malo dosiahnuť podávaním inhibítorov alebo imunomodulatórnych liekov v niekoľkomesačných intervaloch počas dlhšieho obdobia. Liečba môže byť ukončená niekoľko mesiacov po tom, ako sa v krvi nenájdu žiadne CLL bunky.
Emília Flochová - lekárka: Je rozdiel v dostupnosti liečby u nás a v zahraničí?
Kde nájsť pomoc
Národný onkologický ústav (Bratislava)
Onkologický ústav svätej Alžbety (Bratislava)
Východoslovenský onkologický ústav (Košice)
Detská fakultná nemocnica Banská Bystrica
Fakultná nemocnica s poliklinikou F.D.Roosevelta Banská Bystrica
Zdroje:
- Burger J.A., Montserrat E.: Coming full circle: 70 years of chronic lymphocytic leukaemia cell redistribution, from glucocorticoids to inhibitors of B-cell receptor signalling. Blood. 2013. doi:10.1182/blood-2012-08-452607. (online)
- ten Hacken E., Burger J.A.: Molecular Pathways: Targeting the Microenvironment in Chronic Lymphocytic Leukemia−−Focus on the B-Cell Receptor. Clinical Cancer Research. 2013. doi:10.1158/1078-0432.CCR-13-0226. (online)
- Hallek M. Signaling the end of chronic lymphocytic leukaemia: new frontline treatment strategies. Blood. 2013. (online)
- Hallek M., et al.: Guidelines for the diagnosis and treatment of chronic lymphocytic leukaemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute−Working Group 1996 guidelines. Blood. 2008. doi:10.1182/blood-2007-06-093906. (online)
- Ferlay J., Steliarova-Foucher E., Lortet-Tieulent J., Rosso S., Coebergh J.W.W., Comber H., Forman D., Bray F. Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012. Eur J Cancer. 2013 Apr;49(6):1374-403. DOI: 10.1016/j.ejca.2012.12.027. (online)
- Cheson B. CLL’s ‘Very Unusual Year. Medscape. 2014. (online)
- Kay N. Treatment and evaluation of CLL: a complicated affair. Blood. 2006. DOI: http://dx.doi.org/10.1182/blood-2005-11-4501 (online)
- Shanafelt T. Treatment of older patients with chronic lymphocytic leukaemia: key questions and current answers. Haematology. 2013. DOI: 10.1182/ash education-2013.1.158. (online)
- National Cancer Institute Chronic Lymphocytic Leukemia Treatment. (online)
- Tóthová E. Chornická lymfocitová leukémia. Via practica. 2008. (online)
- Mikušková E., Demotrovičová Ľ. CHRONICKÁ LYMFOCYTOVÁ LEUKÉMIA HRONICKÁ LYMFOCYTOVÁ LEUKÉMIA – STAGING A LIEČBA (2. ČASŤ). Onkológia. 2008. (online)
- Mikušková E., Demotrovičová Ľ. CHRONICKÁ LYMFOCYTOVÁ LEUKÉMIA HRONICKÁ LYMFOCYTOVÁ LEUKÉMIA – BIOLÓGIA, KLINICKÝ OBRAZ A PROGNÓZA BIOLÓGIA, KLINICKÝ OBRAZ A PROGNÓZA (1. ČASŤ). Onkológia. 2008. (online)
- Stilgenbauer S., Bullinger L., Lichter P., Döhner H., German CLL Study Group (GCLLSG): Genetics of chronic lymphocytic leukaemia: genomic aberrations and VH gene mutation status in pathogenesis and clinical course. Leukaemia. 2002. (online)
- Blankart C.R., Koch T., Linder R., Verheyen F., Schreyögg J., Stargardt T. Cost of illness and economic burden of chronic lymphocytic leukaemia. Orphanet Journal of Rare Diseases. 2013. (online)
- Kater A.P., van Oers M.H.J., Kipps T.J. Cellular immune therapy for chronic lymphocytic leukaemia. Blood. 2007. DOI: http://dx.doi.org/10.1182/blood-2007-01-068932. (online)
